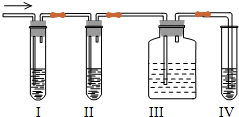
题目内容
用NH4Cl和Ca(OH)2制取氨气的化学方程式为: ,用 方法收集氨气,验满的方法是用玻璃棒蘸取浓盐酸靠近集气瓶口,可以观察到的现象是 ,此反应的化学方程式为 ,在收集氨气的集气瓶口有一团棉花,其作用是 (任写一个),收集的氨气用 干燥.
考点:氨的实验室制法
专题:氮族元素
分析:氯化铵与氢氧化钙在加热条件下反应生成氯化钙、氨气和水;依据氨气极易溶于水,密度小于空气选择收集方法;
氯化氢与氨气常温下反应生成固体氯化铵;氨气有刺激性气味,不能直接排空,所以收集氨气时要有尾气处理装置;
氨气为碱性气体,应选择碱性干燥剂.
氯化氢与氨气常温下反应生成固体氯化铵;氨气有刺激性气味,不能直接排空,所以收集氨气时要有尾气处理装置;
氨气为碱性气体,应选择碱性干燥剂.
解答:
解:氯化铵与氢氧化钙在加热条件下反应生成氯化钙、氨气和水,化学方程式:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
氨气极易溶于水,密度小于空气,只能用向下排空气法收集;
氯化氢与氨气常温下反应生成固体氯化铵,所以用玻璃棒蘸取浓盐酸靠近集气瓶口,会看到大量白烟;
氨气有刺激性气味,不能直接排空,所以收集氨气时要有尾气处理装置,氨气和稀硫酸反应生成硫酸铵,所以收集氨气的试管口通常放一团沾有稀硫酸的棉花;
氨气为碱性气体,应选择碱性干燥剂,碱石灰为碱性干燥剂;
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;向下排空气;产生大量的白烟;HCl+NH3=NH4Cl;吸收尾气;碱石灰.
| ||
氨气极易溶于水,密度小于空气,只能用向下排空气法收集;
氯化氢与氨气常温下反应生成固体氯化铵,所以用玻璃棒蘸取浓盐酸靠近集气瓶口,会看到大量白烟;
氨气有刺激性气味,不能直接排空,所以收集氨气时要有尾气处理装置,氨气和稀硫酸反应生成硫酸铵,所以收集氨气的试管口通常放一团沾有稀硫酸的棉花;
氨气为碱性气体,应选择碱性干燥剂,碱石灰为碱性干燥剂;
故答案为:2NH4Cl+Ca(OH)2
| ||
点评:实验室氨气的制备装置和试剂选择,明确反应的原理和氨气的性质是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是( )
| 被提纯的物质 | 除杂试剂 | 分离方法 | |
| A | 乙酸乙酯(乙酸) | CCl4 | 萃取、分液 |
| B | 乙烷(乙烯) | 高锰酸钾溶液 | 洗气 |
| C | 乙醇(乙酸) | 新制氧化钙 | 蒸馏 |
| D | 苯(溴) | 碘化钾溶液 | 分液 |
| A、A | B、B | C、C | D、D |
下列说法不正确的是( )
| A、天然橡胶的化学组成是聚异戊二烯 |
| B、人造羊毛属于合成纤维 |
| C、通过橡胶硫化,可以使橡胶结构由体型变成线型结构 |
| D、玻璃钢属于复合材料 |
扑热息痛是一种优良的解热镇痛剂,其结构式为 ,它可能具有的化学性质是 ( )
,它可能具有的化学性质是 ( )
 ,它可能具有的化学性质是 ( )
,它可能具有的化学性质是 ( )| A、不与NaOH溶液反应 |
| B、能与浓溴水发生取代反应 |
| C、不能被KMnO4酸性溶液氧化 |
| D、能发生消去反应 |
化学与工农业生产、环境保护、日常生活等方面有广泛联系,下列叙述正确的是( )
| A、地沟油由于混有一些对人体有害的杂质而不能食用,可加工制成生物柴油,生物柴油的成分与从石油中提取的柴油成分相同 |
| B、大豆蛋白、鸡蛋白分别溶于水所形成的分散系为胶体,在加热、甲醛、饱和(NH4)2SO4、X射线作用下,蛋白质的性质都会改变并发生变性 |
| C、棉花和木材的主要成分都是纤维素,蚕丝和羊毛的主要成分都是蛋白质 |
| D、石油裂解和油脂皂化都是高分子生成小分子的过程 |
下列叙述正确的是( )
| A、乙烯和苯都能使溴水褪色,故不能用溴水鉴别乙烯和苯蒸气 |
| B、HNO3能与苯、甲苯、甘油、纤维素等有机物发生重要反应,常用浓硫酸作催化剂 |
| C、仅用新制的氢氧化铜悬浊液一种试剂不可鉴别乙醇、乙醛、乙酸、乙酸乙酯 |
| D、苯与酸性KMnO4溶液混合振荡、静置分层,下层液体为无色 |
下列说法正确的是( )
| A、乙烷与乙炔互为同系物 |
| B、22S与33S是同种核素 |
| C、正丁烷与异丁烷互为同素异形体 |
D、CH3CH2NO2与 互为同分异构体 互为同分异构体 |
现有以下几种措施:①对燃烧煤时产生的尾气进行脱硫处理 ②发展洁净煤技术,开展煤的综合利用 ③燃煤时鼓入足量空气 ④开发清洁能源.其中能减少酸雨产生的措施是( )
| A、①②③ | B、②③④ |
| C、①②④ | D、①③④ |