题目内容
下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A、28g氮气所含有的原子数目为NA |
| B、4g金属钙变成钙离子时失去的电子数目为0.1NA |
| C、lmol甲烷的质量与NA个甲烷分子的质量之和相等 |
| D、标准状况下,22.4L甲烷和乙炔混合物所含的分子数为NA |
考点:阿伏加德罗常数
专题:
分析:A、1mol氮气含2mol原子;
B、根据钙的化合价为+2价;
C、1mol甲烷中含NA个甲烷分子;
D、根据分子数N=nNA来计算.
B、根据钙的化合价为+2价;
C、1mol甲烷中含NA个甲烷分子;
D、根据分子数N=nNA来计算.
解答:
解:A、28g氮气的物质的量为1mol,而1mol氮气含2mol原子,故A错误;
B、4g钙的物质的量为0.1mol,而钙的化合价为+2价,故0.1mol钙变为钙离子时失去0.2mol电子,故B错误;
C、1mol甲烷中含NA个甲烷分子,故lmol甲烷的质量与NA个甲烷分子的质量之和相等,故C正确;
D、标况下,22.4L混合气体的物质的量为1mol,故分子数N=nNA=NA,故D正确.
故选CD.
B、4g钙的物质的量为0.1mol,而钙的化合价为+2价,故0.1mol钙变为钙离子时失去0.2mol电子,故B错误;
C、1mol甲烷中含NA个甲烷分子,故lmol甲烷的质量与NA个甲烷分子的质量之和相等,故C正确;
D、标况下,22.4L混合气体的物质的量为1mol,故分子数N=nNA=NA,故D正确.
故选CD.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、1L1mol?L-1的NaClO 溶液中含有ClO-的数目为NA |
| B、标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2 NA |
| C、常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA |
| D、足量的铜与含2 mol H2SO4的浓硫酸充分反应,可生成NA个SO2分子 |
磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性,制备时将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的NaOH溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子直径在5.5~36nm的磁流体.下列说法中正确的( )
| A、所得的分散系属于悬浊液 |
| B、所得的分散系中分散质为Fe2O3 |
| C、该分散系能产生丁达尔效应 |
| D、所得分散系为胶体,且胶粒直径即为氢氧化铁分子直径 |
分别在pH=1的酸和pH=13的NaOH溶液中加入足量的铝,放出的H2的量前者多,其原因可能是( )
①酸溶液的体积大于NaOH溶液的体积 ②两溶液的体积相同,酸是多元强酸
③酸是强酸,浓度比NaOH溶液的大 ④两溶液的体积相同,酸是一元弱酸.
①酸溶液的体积大于NaOH溶液的体积 ②两溶液的体积相同,酸是多元强酸
③酸是强酸,浓度比NaOH溶液的大 ④两溶液的体积相同,酸是一元弱酸.
| A、①④ | B、④ | C、②③ | D、③ |
下列物质的分子中,属于正四面体结构的是( )
| A、CHCl3 |
| B、CCl4 |
| C、CH2Cl2 |
| D、CH3Cl |
 夏日的夜晚,常看见儿童手持发光的“魔棒”在广场上嬉戏.“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图(式中两个-C5H11相同).下列说法不正确的是( )
夏日的夜晚,常看见儿童手持发光的“魔棒”在广场上嬉戏.“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图(式中两个-C5H11相同).下列说法不正确的是( )| A、魔棒发光过程发生了氧化还原反应 |
| B、1mol草酸二酯与氢氧化钠稀溶液反应时(苯环上卤素不水解),最多消耗6molNaOH |
| C、草酸二酯水解可以得到四种有机物 |
| D、六个氯原子可能在同一平面 |
 1个,则该结构的烃的一氯取代物最多可能有( )种(不考虑立体异构)
1个,则该结构的烃的一氯取代物最多可能有( )种(不考虑立体异构) 反应A(g)+B(g)═C(g)+D(g)过程中的能量变化如图所示,回答下列问题:
反应A(g)+B(g)═C(g)+D(g)过程中的能量变化如图所示,回答下列问题: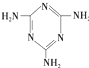 (三聚氰胺)
(三聚氰胺) ),三聚氰酸分子中N原子采取
),三聚氰酸分子中N原子采取 是电石的晶胞示意图,则一个晶胞中含有
是电石的晶胞示意图,则一个晶胞中含有