题目内容
晶体具有规则的几何外形,晶体中最基本的重复单元称为晶胞。NaCl晶体结构如图所示。已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知FexO晶体密度ρ为5.71g/cm3,晶胞边长为4.28×10-10m。(铁相对原子质量为55.9,氧相对原子质量为16)求:

(1)FexO中x值(精确至0.01)为_____________。
(2)晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中,Fe2+所占分数(用小数表示,精确至0.001)为___________。
(3)此晶体化学式为___________。
(4)Fe在此晶体中占据空隙的几何形状是___________(即与O2-距离最近且等距离的铁离子围成的空间形状)。
(5)在晶体中,铁元素的离子间最短距离为________m。
(1)0.92 (2)0.826 (3)19FeO·2Fe2O3 (4)正八面体 (5)3.03×10-10
【解析】试题分析::(1)根据NaCl晶体结构,1个NaCl晶胞是由8个小立方体〔如图(1)〕构成的。每个小立方体为 NaCl,同理在FexO晶体中,每个小立方体为
NaCl,同理在FexO晶体中,每个小立方体为 个FexO,完整晶体中〔如图(2)〕Fe、O交替出现,x=1。
个FexO,完整晶体中〔如图(2)〕Fe、O交替出现,x=1。

每个立方体的质量为:
M(FexO)=2MnA=2×5.6×10-23×6.02×1023=67.4g/mol
56 g/mol×x+16 g/mol×1=67.4 g/mol
x=0.92
设1 mol Fe0.92O中,n(Fe2+)=y mol,则:n(Fe3+)=(0.92-y)mol。根据化合物中各元素正负化合价代数和为零的原则:2×y+3×(0.92-y)+(-2)×1=0
y=0.76;故Fe2+所占分数为0.76/0.92=0.826。
(3)由于Fe2+为0.76,则Fe3+为0.92-0.76=0.16,故化学式为 O。
O。
(4)Fe在晶体中所占空隙的几何形状为正八面体。如图(3)所示

(5)如图(1),铁元素离子间的距离

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案

 2s
2s 3s
3s 4s
4s ,则该元素基态原子的电子排布式为 ;其最高价氧化物对应的水化物的化学式是
,则该元素基态原子的电子排布式为 ;其最高价氧化物对应的水化物的化学式是 
 2s
2s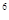 3s
3s 4s
4s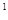 ,则该元素基态原子的电子排布式为
;其最高价氧化物对应的水化物的化学式是
,则该元素基态原子的电子排布式为
;其最高价氧化物对应的水化物的化学式是