题目内容
【题目】(1)25°C时,CH3COOH和NH3H2O的电离常数相等。取10mL0.1molL-1醋酸溶液测得其pH=3。 0.1molL-1氨水(NH3H2O溶液)的pH=_________。用pH试纸测定该氨水pH的操作方法为_______。
(2)某温度(t°C)时,测得0.01 molL-1的NaOH溶液的pH=11,则该温度下水的KW=_________。在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合,若所得混合液为中性,且a+b=12, 则Va: Vb_________。
(3)25°C时,0.1 molL-1的HA溶液中![]() 。请回答下列问题:
。请回答下列问题:
①HA是_________(填“强电解质”或“弱电解质”)。
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是_________(填字母)。
a.c(HA) b.![]() c.c(H+)与c(OH-)的乘积 d.c(OH-)
c.c(H+)与c(OH-)的乘积 d.c(OH-)
【答案】11 将一小片pH试纸放在表面皿上,用玻璃棒或胶头滴管将待测液滴在试纸上,再将变色的试纸与标准比色卡对照读出数值 1×10-13 10:1 弱电解质 bd
【解析】
(1)25℃时,CH3COOH和NH3H2O的电离常数相等,25℃时,0.1mol/L氨水(NH3H2O溶液)电离出的氢氧根离子浓度为10-3mol/L;结合pH试纸测定溶液pH的基本操作要点回答;
(2)该溶液中c(H+)=10-11mol/L、c(OH-)=0.01mol/L,Kw=c(H+).c(OH-);混合溶液呈中性,说明酸中n(H+)等于碱中n(OH-);
(3)①25℃时,0.1mol/L的HaA溶液中 =1010,该溶液中c(H+)c(OH-)=1×10-14,则该溶液中c(H+)=0.01mol/L<0.1mol/L,说明该酸部分电离;
=1010,该溶液中c(H+)c(OH-)=1×10-14,则该溶液中c(H+)=0.01mol/L<0.1mol/L,说明该酸部分电离;
②该酸是弱酸,加水稀释促进电离,但其电离增大程度小于溶液体积增大程度,导致溶液中c(H+)减小,温度不变,水的离子积常数不变。
(1)25℃时,CH3COOH和NH3H2O的电离常数相等,25℃时,0.1mol/L氨水(NH3H2O溶液)电离出的氢氧根离子浓度为10-3mol/L,溶液PH=11,pH试纸测定pH的方法是:将一小片pH试纸放在表面皿上,用玻璃棒或胶头滴管将待测液滴在试纸上,再将变色的试纸与标准比色卡对照读出数值;
(2)该溶液中c(H+)=10-11mol/L、c(OH-)=0.01mol/L,Kw=c(H+).c(OH-)=10-11×0.01=1×10-13,该温度下,pH=a的NaOH溶液中c(OH-)=10a-13,pH=b的H2SO4溶液c(H+)=10-bmol/L,
混合溶液呈中性,说明酸中n(H+)等于碱中n(OH-),且a+b=12,则c(OH-)=10a-13×Va=10-b×Vb L,Va:Vb=10:1;
(3)①25℃时,0.1mol/L的HA溶液中 =1010,该溶液中c(H+)c(OH-)=1×10-14,则该溶液中c(H+)=0.01mol/L<0.1mol/L,说明该酸部分电离,则该酸是弱电解质;
=1010,该溶液中c(H+)c(OH-)=1×10-14,则该溶液中c(H+)=0.01mol/L<0.1mol/L,说明该酸部分电离,则该酸是弱电解质;
②a.该酸是弱酸,加水稀释促进电离,则溶液中c(HA)减小,故a错误;
b.加水稀释促进该酸电离,溶液中氢离子物质的量增大、酸的物质的量减小,则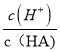 增大,故b正确;
增大,故b正确;
c.温度不变,水的离子积常数不变,则c(H+)与c(OH-)的乘积不变,故c错误;
d.温度不变,水的离子积常数不变,因为加水稀释虽然促进酸电离,但酸电离增大程度小于溶液体积增大程度,导致溶液中氢离子浓度减小,则c(OH-)增大,故d正确;
故答案为bd。

【题目】已知某化学反应的平衡常数表达式为![]() ,在不同的温度下该反应的平衡常数如表所示:
,在不同的温度下该反应的平衡常数如表所示:
t/°C | 700 | 800 | 830 | 1000 | 1200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是
A.该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.若平衡浓度符合下列关系式:![]() ,则此时的温度为1 000 °C
,则此时的温度为1 000 °C
D.在1L的密闭容器中通入CO2和H2各1mol,5 min后温度升高到830°C,此时测得CO为0.4 mol,则该反应达到平衡状态
【题目】某实验小组探究补铁口服液中铁元素的价态,并测定该补铁口服液中铁元素的含量是否达标。
![]()
(1)实验一:探究补铁口服液中铁元素的价态。
甲同学:取1 mL补铁口服液,加入K3[Fe(CN)6](铁氰化钾)溶液,生成蓝色沉淀,证明该补铁口服液中铁元素以Fe2+形式存在。
乙同学:取5 mL补铁口服液,滴入10滴KSCN溶液无现象,再滴入10滴双氧水,未见到红色。乙同学为分析没有出现红色实验现象的原因,将上述溶液平均分为3份进行探究:
原因 | 实验操作及现象 | 结论 | ||
1 | 其他原料影响 | 乙同学观察该补铁口服液的配料表,发现其中有维生素C,维生素C有还原性,其作用是①______ | 取第1份溶液,继续滴入足量的双氧水,仍未见红色出现 | 排除②_________影响 |
2 | 量的原因 | 所加③________溶液(写化学式)太少,二者没有达到反应浓度 | 取第2份溶液,继续滴加该溶液至足量,仍然未出现红色 | 说明不是该溶液量少的影响 |
3 | 存在形式 | 铁的价态是+3价,但可能不是以自由离子Fe3+形式存在 | 取第3份溶液,滴加1滴稀硫酸,溶液迅速变为红色 | 说明Fe3+以④_______形式存在,用化学方程式结合文字,说明加酸后迅速显红色的原因 |
(2)甲同学注意到乙同学加稀硫酸变红后的溶液,放置一段时间后颜色又变浅了,他分析了SCN-中各元素的化合价,然后将变浅后的溶液分为两等份:一份中滴人KSCN溶液,发现红色又变深;另一份滴入双氧水,发现红色变得更浅,但无沉淀,也无刺激性气味的气体生成。根据实验现象,用离子方程式表示放置后溶液颜色变浅的原因________。
(3)实验二:测量补铁口服液中铁元素的含量是否达标。
该补铁口服液标签注明:本品含硫酸亚铁(FeSO4·7H2O)应为375~425(mg/100 mL),该实验小组设计如下实验,测定其中铁元素的含量。(说明:该实验中维生素C的影响已排除,不需要考虑维生素C消耗的酸性KMnO4溶液)
①取该补铁口服液100 mL,分成四等份,分别放入锥形瓶中,并分别加入少量稀硫酸振荡;
②向 ________式滴定管中加入0.002 mol.L-l酸性KMnO4溶液,并记录初始体积;
③滴定,直至溶液恰好_____________且30秒内不褪色,记录末体积;
④重复实验。根据数据计算,平均消耗酸性KMnO4溶液的体积为35.00 mL。计算每100 mL该补铁口服液中含铁元素__________mg(以FeSO4·7H2O的质量计算),判断该补铁口服液中铁元素含量___________(填“合格”或“不合格”)。




