题目内容
下列说法正确的是( )
| A、有人利用ZrO2作为固体电解质(允许O2-通过)制造出了常温下的甲醇一空气燃料电池.当原电池中有0.5 mol甲醇消耗时,则负极消耗O2-的物质的量为1.5mol | |||
B、标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为ρ g/ml,质量分数为ω,物质浓度为c mol/L,则ρ=
| |||
C、已知常温下,氢氧化镁的溶度积常数为a,则氢氧化镁悬浊液中C(OH-)=
| |||
| D、将11.2g的Mg和Cu混合物完全溶解于足量的硝酸中,收集反应产生的x气体. 再向所得溶液中加入适量的NaOH溶液,产生21.4g沉淀.根据题意推断气体x的成分可能是0.2mol NO2和0.1mol N2O4 |
考点:原电池和电解池的工作原理,化学方程式的有关计算,物质的量浓度的相关计算,难溶电解质的溶解平衡及沉淀转化的本质
专题:计算题,基本概念与基本理论
分析:A、根据负极的电极方程和转移电子计算氧离子的物质的量;
B、由表达式可知,该密度=
;
C、氢氧化镁悬浊液中c(OH-)=2c(Mg2+);
D、向Mg-Cu混合物与足量的硝酸反应所得溶液中加入适量的NaOH溶液,产生21.4g沉淀为氢氧化镁、氢氧化铜,所以沉淀中氢氧根的质量为21.4g-11.2g=10.2g,物质的量为
=0.6mol,根据电荷守恒可知,11.2g的Mg-Cu提供的电子为0.6mol,结合电子转移守恒判断.
B、由表达式可知,该密度=
| 溶液质量 |
| 溶液体积 |
C、氢氧化镁悬浊液中c(OH-)=2c(Mg2+);
D、向Mg-Cu混合物与足量的硝酸反应所得溶液中加入适量的NaOH溶液,产生21.4g沉淀为氢氧化镁、氢氧化铜,所以沉淀中氢氧根的质量为21.4g-11.2g=10.2g,物质的量为
| 10.2g |
| 17g/mol |
解答:
解:A、负极的电极方程CH4O+3O2--6e-=CO2+2H2O,则当原电池中有0.5 mol甲醇消耗时,负极消耗O2-的物质的量为1.5mol,故A正确;
B、由表达式可知,该密度=
,溶液体积不等于氨气体积与水的体积之和,故B错误;
C、氢氧化镁悬浊液中c(OH-)=2c(Mg2+),则c(OH-)=
mol/L,故C错误;
D、向Mg-Cu混合物与足量的硝酸反应所得溶液中加入适量的NaOH溶液,产生21.4g沉淀为氢氧化镁、氢氧化铜,所以沉淀中氢氧根的质量为21.4g-11.2g=10.2g,物质的量为
=0.6mol,根据电荷守恒可知,11.2g的Mg-Cu提供的电子为0.6mol,若生成0.2mo1NO2和0.1mo1N2O4,N元素获得电子为0.2mol×(5-4)+0.1mol×2×(5-4)=0.4mol,得失电子不相等,故D错误.
故选A.
B、由表达式可知,该密度=
| 溶液质量 |
| 氨气体积+水的体积 |
C、氢氧化镁悬浊液中c(OH-)=2c(Mg2+),则c(OH-)=
| 3 | 2a |
D、向Mg-Cu混合物与足量的硝酸反应所得溶液中加入适量的NaOH溶液,产生21.4g沉淀为氢氧化镁、氢氧化铜,所以沉淀中氢氧根的质量为21.4g-11.2g=10.2g,物质的量为
| 10.2g |
| 17g/mol |
故选A.
点评:本题考查了燃料电池的计算、Ksp的应用、氧化还原反应计算等,难度中等,计算金属提供的电子的物质的量是解题的关键,注意守恒思想的运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
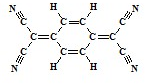 目前,世界上已合成了几百种有机超导体,TCNQ是其中之一.TCNQ的分子结构如图所示.下列关于TCNQ说法错误的为( )
目前,世界上已合成了几百种有机超导体,TCNQ是其中之一.TCNQ的分子结构如图所示.下列关于TCNQ说法错误的为( )| A、分子中所有的氮原子在同一平面内 |
| B、属于芳香族化合物 |
| C、能发生加聚反应 |
| D、该物质难溶于水 |
下列表述正确的是( )
A、羟基的电子式 |
| B、醛基的结构简式-COH |
C、1-丁烯的键线式 |
D、聚丙烯的结构简式 |
某溶液中存在大量的H+、Cl-、Fe3+,该溶液中还可能大量存在的离子是( )
| A、OHˉ |
| B、Ag+ |
| C、CO32- |
| D、SO42- |
下列物质即能发生消去反应也能发生氧化反应氧化为羧酸的是( )
| A、CH3CH2CH2OH |
| B、CH3OH |
| C、(CH3)2CHOH |
| D、(CH3)3COH |
医疗上给病人输液补充能量,常用的糖是( )
| A、葡萄糖 | B、麦芽糖 |
| C、淀粉 | D、纤维素 |
某种蛋白酶由100个氨基酸脱水缩合而成,下列叙述正确的是( )
| A、该酶分子结构中至少含有99个氨基和99个羧基 |
| B、控制该酶合成的基因片段至少有300对碱基 |
| C、该酶从细胞中分泌出来需要载体的协助 |
| D、用含该酶的洗衣粉去除奶渍,效果比其他类型的加酶洗衣粉好 |
