题目内容
在下列各溶液中,离子一定能大量共存的是
- A.强碱性溶液中:K+、Mg2+、Cl-、
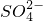
- B.室温下,pH=1的盐酸中:Na+、Fe3+、
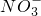 、
、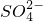
- C.含有Ca2+的溶液中:Na+、K+、
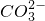 、Cl-
、Cl- - D.由水电离产生的c(H+)=1×10-13mol/L的溶液中:Na+、K+、Cl-、

B
分析:A.强碱性溶液含OH-,离子之间结合生成沉淀;
B.pH=1的盐酸中该组离子之间不反应;
C.离子之间结合生成沉淀;
D.由水电离产生的c(H+)=1×10-13mol/L的溶液,为酸或碱溶液.
解答:A.强碱性溶液含OH-,与Mg2+离子结合生成沉淀,则不能共存,故A错误;
B.pH=1的盐酸中该组离子之间不反应,则能够大量共存,故B正确;
C.Ca2+、CO32-离子之间结合生成沉淀,则不能共存,故C错误;
D.由水电离产生的c(H+)=1×10-13mol/L的溶液,为酸或碱溶液,酸溶液中H+、SiO32-结合生成硅酸沉淀,则不能共存,故D错误;
故选B.
点评:本题考查离子的共存,明确习题中的信息及复分解反应发生的条件即可解答,题目难度不大,注意硅酸为不溶于水的酸.
分析:A.强碱性溶液含OH-,离子之间结合生成沉淀;
B.pH=1的盐酸中该组离子之间不反应;
C.离子之间结合生成沉淀;
D.由水电离产生的c(H+)=1×10-13mol/L的溶液,为酸或碱溶液.
解答:A.强碱性溶液含OH-,与Mg2+离子结合生成沉淀,则不能共存,故A错误;
B.pH=1的盐酸中该组离子之间不反应,则能够大量共存,故B正确;
C.Ca2+、CO32-离子之间结合生成沉淀,则不能共存,故C错误;
D.由水电离产生的c(H+)=1×10-13mol/L的溶液,为酸或碱溶液,酸溶液中H+、SiO32-结合生成硅酸沉淀,则不能共存,故D错误;
故选B.
点评:本题考查离子的共存,明确习题中的信息及复分解反应发生的条件即可解答,题目难度不大,注意硅酸为不溶于水的酸.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目