题目内容
|
高铁酸钾是一种理想的绿色水处理剂,工业上可通过如下反应制得: Fe(OH)3+ClO-+OH――FeO42-+Cl-+H2O(未配平),在上述反应中 | |
| [ ] | |
A. |
FeO42-是还原产物 |
B. |
ClO-是还原剂 |
C. |
1 mol Fe(OH)3得到3 mol电子 |
D. |
配平后OH-的化学计量数为4 |
答案:D

练习册系列答案
相关题目
(12分)高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
|
湿法 |
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
|
干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
①反应I的化学方程式为 ▲ 。
②反应II的离子方程式为 ▲ 。
③加入饱和KOH溶液的目的是 ▲ 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ▲ ,____▲______。
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为 ▲ 。
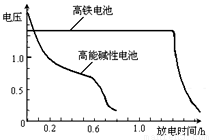
(4)高铁电池是正在研制中的可充电干电池,上图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ▲ 、 ▲ 。


 右图为该电池和常用的高能碱性
右图为该电池和常用的高能碱性

