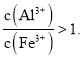题目内容
【题目】某反应中反应物与生成物有![]() 、
、![]() 、
、![]() 、Cu。
、Cu。
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:
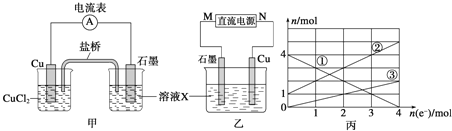
①图中X溶液的溶质是______________________;
②Cu电极上发生的电极反应式为_________________;
③原电池工作时,盐桥中的_______________离子![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 不断进入X溶液中。
不断进入X溶液中。
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是___________极;
②图丙中的②线是_______________离子的变化。
③当电子转移为2mol时,向乙烧杯中加入_________![]() 溶液才能使所有的金属阳离子沉淀完全。
溶液才能使所有的金属阳离子沉淀完全。
【答案】![]() 、
、![]()
![]()
![]() 负
负 ![]()
![]()
【解析】
(1)根据所给物质,能发生氧化还原反应的是Cu+2Fe3+=2Fe2++Cu,装置甲为电池,溶液X为FeCl3和FeCl2,以及原电池工作原理,据此分析;
(2)根据丙图可知溶液中有三种金属阳离子,而根据X的成分可知X中只有两种金属阳离子,说明在电解过程中还有Cu2+生成,Cu作阳极,石墨作阴极,据此分析;
(1)①甲为电池,发生氧化还原反应,据反应物和生成物可以确定该反应为![]() , X为
, X为![]() 、
、![]() 溶液;
溶液;
答案为:![]() 、
、![]() ;
;
②根据①的分析,Cu为负极,Cu电极上发生的电极反应式为:![]() ;
;
答案为:![]() ;
;
③原电池工作时,电解质溶液中阳离子移向正极,阴离子移向负极,石墨为正极,盐桥中的![]() 离子不断进入X溶液中;
离子不断进入X溶液中;
答案为:![]() ;
;![]()
(2)①根据丙图可知溶液中有三种金属阳离子,而根据X的成分可知X中只有两种金属阳离子,说明在电解过程中还有![]() 生成,因此Cu作阳极,石墨作阴极,所以M是负极;
生成,因此Cu作阳极,石墨作阴极,所以M是负极;
答案为:负;
②根据丙图可知溶液中有三种金属阳离子,根据转移电子的物质的量和金属阳离子的物质的量的变化,可知①为![]() ,②为
,②为![]() ,③为
,③为![]() ;
;
答案为:![]() ;
;
②当电子转移为2mol时,溶液中有![]() ,
,![]() ,
,![]() 为1mol,所以需要加入NaOH溶液14mol,所以NaOH溶液等体积为
为1mol,所以需要加入NaOH溶液14mol,所以NaOH溶液等体积为![]() ;
;
答案为:![]() 。
。

 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案