题目内容
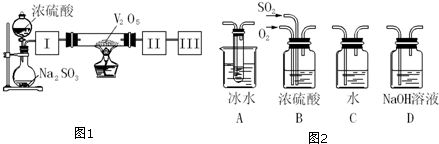
16. 实验室可用浓硫酸和亚硫酸钠固体制备SO2,并验证其相关性质.装置如图所示
实验室可用浓硫酸和亚硫酸钠固体制备SO2,并验证其相关性质.装置如图所示(1)盛装亚硫酸钠的仪器名称为圆底烧瓶
(2)生成SO2的化学方程式为.如果X是氯化铁溶液,反应后现象为,说明了SO2的还原 性.当消耗标况下2.24LSO2时,Fe3+转移电子数为0.2NA
(3)SO2和CO2的性质相似.将足量的SO2通入下列溶液中,能产生沉淀的是AB (填字母)
A.硅酸钠溶液 B.硝酸钡溶液C.氯化钡溶液D.氢氧化钠溶液
(4)为了防止SO2对环境的污染,X后应连接盛装(3)所列D 溶液的尾气吸收装置(填字母).反应后,若生成物为单一成分时,溶质可能为Na2SO3或NaHSO3 (化学式)
分析 (1)装置图中仪器图形和作用可知盛装亚硫酸钠的仪器为圆底烧瓶;
(2)亚硫酸钠和浓硫酸反应生成二氧化硫、硫酸钠和水,二氧化硫具有还原性,氯化铁溶液具有氧化性,二者发生氧化还原反应溶液由黄色变为浅绿色,依据化学反应的离子方程式和电子转移总数计算;
(3)二氧化硫为酸性氧化物,与碱、盐溶液等可发生反应,结合强酸制取弱酸的反应原理来解答,注意硝酸钡溶液中硝酸根离子在酸性溶液中具有强氧化性的隐含条件;
(4)二氧化硫是酸性氧化物可以被强碱溶液吸收,反应生成产物若生成物为单一成分时,可以是亚硫酸钠或亚硫酸氢钠.
解答 解:(1)装置图中仪器图形和作用可知,盛装亚硫酸钠的仪器为圆底烧瓶,
故答案为:圆底烧瓶;
(2)亚硫酸钠和浓硫酸反应生成二氧化硫、硫酸钠和水,反应的化学方程式为:Na2SO3+H2SO4(浓)═Na2SO4+H2O+SO2↑,二氧化硫具有还原性,氯化铁溶液具有氧化性,二者发生氧化还原反应,2FeCl3+SO2+2H2O=2FeCl2+H2SO4+2HCl,溶液由黄色变为浅绿色,依据化学反应的离子方程式和电子转移总数计算,反应1molSO2电子转移总数为2mol,当消耗标况下2.24LSO2时,二氧化硫物质的量=$\frac{2.24L}{22.4L/mol}$=0.1mol,电子转移总数为0.2mol,依据电子守恒得到Fe3+转移电子数为0.2mol×NA=0.2NA,
故答案为:Na2SO3+H2SO4(浓)═Na2SO4+H2O+SO2↑,溶液由黄色变为浅绿色,还原,0.2NA;
(3)二氧化硫为酸性氧化物,与碱、盐溶液等可发生反应,结合强酸制取弱酸的反应原理来解答,注意硝酸钡溶液中硝酸根离子在酸性溶液中具有强氧化性的隐含条件,
A.硅酸钠溶液中通入二氧化硫反应生成硅酸沉淀和亚硫酸钠,有硅酸白色沉淀生成,故A符合;
B.硝酸钡溶液融入二氧化硫气体,在酸性溶液中硝酸根离子具有氧化性能氧化二氧化硫为硫酸,硫酸根离子结合钡离子生成硫酸钡白色沉淀,故B符合;
C.氯化钡溶液中通入二氧化硫气体,盐酸酸性大于亚硫酸,所以不能发生反应,故C不符合;
D.氢氧化钠溶液中通入二氧化硫气体反应生成亚硫酸钠或亚硫酸氢钠溶液,无沉淀生成,故D不符合;
故答案为:AB;
(4)二氧化硫是酸性氧化物,属于污染性气体,需要尾气吸收,二氧化硫可以被强碱溶液吸收,所以选择D中的氢氧化钠溶液可以吸收二氧化硫气体,SO2+2NaOH=Na2SO3+H2O或SO2+NaOH=NaHSO3,反应生成产物若生成物为单一成分时,可以是亚硫酸钠或亚硫酸氢钠,
故答案为:D,Na2SO3或NaHSO3.
点评 本题考查了二氧化硫的实验制备、二氧化硫的性质分析应用,注意氧化还原反应电子转移的计算和尾气吸收的原理掌握,题目难度中等.

 阅读快车系列答案
阅读快车系列答案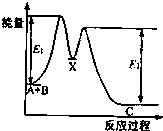 反应A+B→C分两步进行:①A+B→X;②X→C.反应过程中能量变化如图所示.下列有关叙述正确的是( )
反应A+B→C分两步进行:①A+B→X;②X→C.反应过程中能量变化如图所示.下列有关叙述正确的是( )| A. | E2表示反应X→C的反应热 | |
| B. | A+B→C此反应放热 | |
| C. | X是反应A+B→C的催化剂 | |
| D. | 加入催化剂可改变反应A+B→C的反应热 |
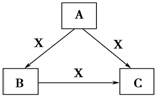 A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )
A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )| A. | 若A、B、C均为焰色反应呈黄色的化合物,则X可为CO2 | |
| B. | 若X为KOH溶液,则A可为AlCl3 | |
| C. | 若X为O2,则A可为硫化氢 | |
| D. | 若X为Cl2,则C可为FeCl3 |
①苯的间位二元取代物只有一种;
②苯能在加热和催化剂存在的条件下与氢气加成生成环己烷;
③苯分子中碳碳键的键长均相等(键长是指在分子中两个成键的原子的核间距离);
④苯不能使酸性KMnO4溶液褪色;
⑤苯的邻位二元取代物只有一种;
⑥苯在FeBr3存在的条件下同液溴发生取代反应.
| A. | ①②③④ | B. | ③④⑤⑥ | C. | ②③④⑥ | D. | 全部 |
| A. | Na+、Al3+、Cl-、CO32- | B. | H+、Na+、Fe2+、MnO4- | ||
| C. | K+、Ca2+、Cl-、CO32- | D. | K+、NO3-、OH-、SO42- |
 回答下列问题
回答下列问题 系统命名法为3,3,5,5-四甲基庚烷,
系统命名法为3,3,5,5-四甲基庚烷, ,
,