题目内容
18.下列物质中,既能与硫化氢应,又能与溴水反应的是( )①硫化钠溶液 ②二氧化硫饱和溶液 ③硫酸铜溶液 ④硝酸银溶液 ⑤亚硫酸钠溶液.
| A. | ①②③④⑤ | B. | ①③⑤ | C. | ①②④⑤ | D. | ②④⑤ |
分析 硫化氢具有还原性,其水溶液具有酸性,所以硫化氢能和强氧化性物质、碱性氧化物、碱、硫化钠等物质反应;溴具有强氧化性,溴的水溶液呈酸性,所以溴能与还原性物质、碱性物质等反应,据此分析解答.
解答 解:①硫化钠溶液与硫化氢反应生成硫氢化钠,能被溴氧化生成S单质,故正确;
②二氧化硫和硫化氢发生氧化还原反应生成S,和溴水发生氧化还原反应生成硫酸和氢溴酸,故正确;
③硫酸铜溶液和硫化氢反应生成CuS沉淀,和溴不反应,故错误;
④硝酸银溶液和硫化氢反应生成硫化银沉淀,和溴水反应生成溴化银沉淀,故正确;
⑤亚硫酸钠溶液和硫化氢发生氧化还原反应,和溴发生氧化还原反应生成硫酸钠,故正确;
故选C.
点评 本题以氧化还原反应为载体考查元素化合物知识,为高频考点,明确物质性质是解本题关键,注意:硫化氢和硫化钠能反应生成酸式盐,硫化氢和硫酸铜反应生成强酸,是中学阶段学习的一个重要弱酸制取强酸的反应,题目难度不大.

练习册系列答案
相关题目
8.不用外加试剂把下列溶液鉴别出来的先后顺序正确的是( )
①CuCl2
②NaNO3
③MgCl2
④NaOH.
①CuCl2
②NaNO3
③MgCl2
④NaOH.
| A. | ①②③④ | B. | ①③④② | C. | ④①②③ | D. | ①④③② |
9.某无色溶液中存在大量NH${\;}_{4}^{+}$、H+、Cl-,还可能大量存在的离子是( )
| A. | CO${\;}_{3}^{2-}$ | B. | Al3+ | C. | Cu2+ | D. | OH- |
13.元素周期表有多种形式.如图是一种三角形元素素周期表的一部分,下列说法正确的是( )

| A. | M的氧化物易溶于水 | |
| B. | 碳的最简单氢化物的稳定性强于A的 | |
| C. | 钾和B组成的化合物的水溶液显碱性 | |
| D. | A、B形成的化合物中可能含有离子键 |
3.化学与科学、技术、社会、环境密切相关.下列叙述中不正确的是( )
| A. | “血液透析”利用了胶体的性质 | |
| B. | 竹炭具有超强的吸附能力,能吸附新装修房屋内的有害气体 | |
| C. | 小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| D. | 海水淡化可以解决淡水危机,向海水中加入明矾可以使海水淡化 |
3.草酸合铁酸钾晶体Kx[Fe(C2O4)y]•3H2O是一种光敏材料,下面是一种制备草酸合铁酸钾晶体的实验流程.

已知:(NH4)2SO4、FeSO4•7H2O、莫尔盐[(NH4)2SO4•FeSO4•6H2O]的溶解度如下表:
(1)“溶解1”应保证铁屑稍过量,其目的是防止Fe2+被氧化为Fe3+.“溶解2”加“几滴H2SO4”的作用是抑制Fe2+水解.
(2)“复分解”制备莫尔盐晶体的基本实验步骤是:蒸发浓缩、冷却结晶、过滤、用乙醇洗涤、干燥.用乙醇洗涤的目的是洗去杂质,减少莫尔盐晶体溶解损失,便于快速干燥.
(3)“沉淀”时得到的FeC2O4•2H2O沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是用小试管取少量最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,说明沉淀没有洗涤干净,否则,沉淀已洗涤干净.
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是黑暗可以防止晶体分解.
(5)请补全测定草酸合铁酸钾产品中Fe3+含量的实验步骤【备选试剂:KMnO4溶液、锌粉、铁粉、NaOH溶液】:
步骤1:准确称取所制备的草酸合铁酸钾晶体a g,配成250mL待测液.
步骤2:用移液管移取25.00mL待测液于锥形瓶中,加入稀H2SO4酸化,加入足量KMnO4溶液,C2O42-转化为CO2被除去.
步骤3:向步骤2所得溶液中加入稍过量的锌粉加热至充分反应(溶液黄色刚好消失),过滤、洗涤、将过滤及洗涤所得溶液收集到锥形瓶中.
步骤4:用c mol•L-1 KMnO4标准溶液滴定步骤3所得溶液至终点,消耗V mL KMnO4标准溶液.

已知:(NH4)2SO4、FeSO4•7H2O、莫尔盐[(NH4)2SO4•FeSO4•6H2O]的溶解度如下表:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| (NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
| FeSO4•7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | - |
| (NH4)2SO4•FeSO4•6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(2)“复分解”制备莫尔盐晶体的基本实验步骤是:蒸发浓缩、冷却结晶、过滤、用乙醇洗涤、干燥.用乙醇洗涤的目的是洗去杂质,减少莫尔盐晶体溶解损失,便于快速干燥.
(3)“沉淀”时得到的FeC2O4•2H2O沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是用小试管取少量最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,说明沉淀没有洗涤干净,否则,沉淀已洗涤干净.
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是黑暗可以防止晶体分解.
(5)请补全测定草酸合铁酸钾产品中Fe3+含量的实验步骤【备选试剂:KMnO4溶液、锌粉、铁粉、NaOH溶液】:
步骤1:准确称取所制备的草酸合铁酸钾晶体a g,配成250mL待测液.
步骤2:用移液管移取25.00mL待测液于锥形瓶中,加入稀H2SO4酸化,加入足量KMnO4溶液,C2O42-转化为CO2被除去.
步骤3:向步骤2所得溶液中加入稍过量的锌粉加热至充分反应(溶液黄色刚好消失),过滤、洗涤、将过滤及洗涤所得溶液收集到锥形瓶中.
步骤4:用c mol•L-1 KMnO4标准溶液滴定步骤3所得溶液至终点,消耗V mL KMnO4标准溶液.
 病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签如图,则该注射液中葡萄糖的质量分数为5%物质的量浓度为0.28 mol/L.
病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签如图,则该注射液中葡萄糖的质量分数为5%物质的量浓度为0.28 mol/L.
 .
.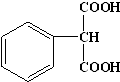 .
.