题目内容
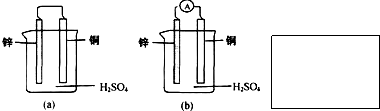
如图是化学能与电能相互转换的两套装置,对此两套装置的分析正确的是( )

| A.两装置中,铁电极上均有较大量气体产生 |
| B.图2装置中铁片上发生氧化反应 |
| C.石墨电极上发生的电极反应均为:2H++2e-=H2↑ |
| D.随着反应的进行,图1中溶液的pH增大,图2中溶液的pH减小 |

A、图1装置是原电池,较活泼的金属铁作负极,负极上铁失电子生成二价铁离子加入溶液,图2是电解池,连接负极的铁作阴极,阴极上氢离子得电子生成氢气,故A错误;
B、图2是电解池,是把电能转化为化学能的装置,铁做阴极,溶液中的氢离子得到电子发生还原反应,故B错误;
C、图1装置是原电池,石墨作正极,正极上氢离子得电子生成氢气2H++2e-=H2↑;图2 是电解池,连接正极的石墨作阳极,阳极上氢氧根离子失电子生成氧气4OH--4e-=O2↑+2H2O,故C错误;
D、图1装置是原电池,石墨作正极,负极上铁失电子生成二价铁离子进入溶液,正极上氢离子得电子生成氢气2H++2e-=H2↑,导致溶液中氢离子浓度降低,溶液的PH值增大;图2装置是电解池,阳极上氢氧根离子失电子生成氧气,阴极上氢离子得电子生成氢气,所以溶液中氢离子和氢氧根离子的浓度不大,pH值不变,故D正确;
故选D.
B、图2是电解池,是把电能转化为化学能的装置,铁做阴极,溶液中的氢离子得到电子发生还原反应,故B错误;
C、图1装置是原电池,石墨作正极,正极上氢离子得电子生成氢气2H++2e-=H2↑;图2 是电解池,连接正极的石墨作阳极,阳极上氢氧根离子失电子生成氧气4OH--4e-=O2↑+2H2O,故C错误;
D、图1装置是原电池,石墨作正极,负极上铁失电子生成二价铁离子进入溶液,正极上氢离子得电子生成氢气2H++2e-=H2↑,导致溶液中氢离子浓度降低,溶液的PH值增大;图2装置是电解池,阳极上氢氧根离子失电子生成氧气,阴极上氢离子得电子生成氢气,所以溶液中氢离子和氢氧根离子的浓度不大,pH值不变,故D正确;
故选D.

练习册系列答案
相关题目
 RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,下列有关说法正确的是( )
RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,下列有关说法正确的是( )