题目内容
相同材质的铁在下图中的四种情况下最不易被腐蚀的是 ( )



A B C D
C
解析试题分析:A、铁做负极、铜做正极,食醋为电解质溶液,形成原电池,铁发生电化学腐蚀,故A不选;B、铁做负极、合金中的碳等材料做正极,食盐水为电解质溶液,形成原电池,铁发生电化学腐蚀,故B不选;C、铁被均匀的铜镀层保护,不易被腐蚀,故C正确;D、铁做负极、铜做正极,酸雨为电解质溶液,形成原电池,铁发生电化学腐蚀,故D不选,故选C。
考点:考查金属的腐蚀及防护

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案滴有酚酞和氯化钠试液的湿润滤纸分别做甲乙两个实验,能发现附近变成红色的电极是

甲 乙
| A. a、c | B. b、d | C. a、d | D. b、c |
某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4=Li2Mn2O4。下列说法正确的是 ( )
| A.放电时,LiMn2O4发生氧化反应 |
| B.放电时,正极反应为:Li++LiMn2O4+e-==Li2Mn2O4 |
| C.充电时,LiMn2O4发生氧化反应 |
| D.充电时,阳极反应为:Li++e-==Li |
英国赫瑞瓦特大学陶善文博士研究出以尿素为动力的燃 料电池新技术。用这种电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电。尿素燃料电池结构如图所示,关于该电池描述正确的是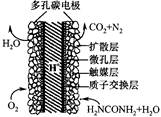
| A.电池工作时H+移向负极 |
| B.该装置还可以将电能转化成为化学能 |
| C.理论上电池工作时,每消耗67.2L O2时,可以净化2mol CO(NH2)2 |
| D.电池的负极反应式为:CO(NH2)2+H2O-6e-=CO2+N2+6H+ |
用铂电极电解100mL HNO3与 AgNO3的混合液,通电一段时间后,两极均收集到2.24 L 气体(标准状况),则原混合液中Ag+的物质的量浓度为 ( )
| A.1mol/L | B.2mol/L | C.2.5mol/L | D.3mol/L |
中学教材引入了带盐桥的原电池,该电池即为1806年丹尼尔设计的原电池。如图,下列有关分析正确的是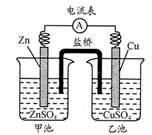
| A.负极发生氧化反应:Cu—2e—=Cu2+ |
| B.电池工作时,盐桥逐渐变蓝 |
| C.向乙池中通入H2S后,电池反应停止 |
| D.若将电极Cu改为石墨,电池电流强度发生变化 |
某电化学实验装置如图所示,下列说法正确的是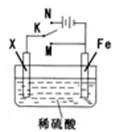
| A.若X为碳棒,开关K置于M处,则溶液中的H+移向Fe极 |
| B.若X为碳棒,开关K置于N处,转移0.2mole一时析出0.lmolO2 |
| C.若X为铜棒,开关K置于M或N处,均可减缓铁的腐蚀 |
| D.若X为锌棒,开关K置于M或N处,锌电极上反应均为Zn-2e一=Zn2+ |
下列有关电池的说法不正确的是
| A.手机上用的锂离子电池属于二次电池 |
| B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 |
| C.氢氧燃料电池可把化学能转化为电能 |
| D.锌锰干电池中,锌电极是负极 |
关于下列各装置图的叙述中,正确的是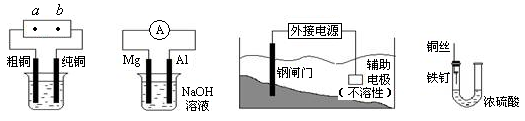
① ② ③ ④
| A.用装置①精炼铜,则a极为电源正极,电解质溶液为CuSO4溶液 |
| B.装置②中Mg为负极 |
| C.装置③中钢闸门应与外接电源的正极相连 |
| D.装置④中的铁钉被腐蚀 |