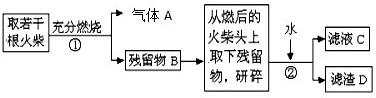
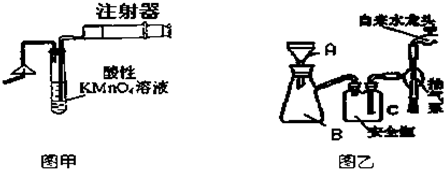
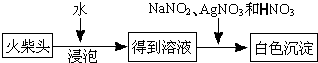
题目内容
NA代表阿伏加德罗常数,下列叙述正确的是( )
| A、1molCl2在反应中得到电子数不一定为2NA |
| B、1molO2在反应中得到电子数一定为4 NA |
| C、1mo1Na2O2与足量H2O反应,转移了2 NA 个电子 |
| D、在2KClO3+4HC1(浓)═2KCl+2C1O2↑+C12↑+2H2O中,氯气既是氧化产物又是还原产物 |
考点:阿伏加德罗常数
专题:
分析:A、1mol氯气在反应时可能发生歧化反应;
B、1mol氧气在反应中得到的电子数取决于反应后氧元素的价态;
C、Na2O2与H2O的反应为歧化反应;
D、该反应中氯元素化合价由+5价、-1价变为0价,所以氯酸钾是氧化剂、浓盐酸是还原剂,再结合物质之间的反应来分析解答.
B、1mol氧气在反应中得到的电子数取决于反应后氧元素的价态;
C、Na2O2与H2O的反应为歧化反应;
D、该反应中氯元素化合价由+5价、-1价变为0价,所以氯酸钾是氧化剂、浓盐酸是还原剂,再结合物质之间的反应来分析解答.
解答:
解:A、1mol氯气在反应时可能发生歧化反应或可逆反应,故不一定得到2mol电子,故A正确;
B、1mol氧气在反应中得到的电子数取决于反应后氧元素的价态,如果反应后氧元素变为-2价,则得4mol电子,如果变为-1价,则得2mol电子,故B错误;
C、Na2O2与H2O的反应为歧化反应:2Na2O2+2H2O=4NaOH+O2↑此反应中,2molNa2O2转移2mol电子,故1molNa2O2转移1mol电子,故C错误;
D、该反应中氧化剂是氯酸钾、浓盐酸是还原剂,根据在归中反应中化合价只靠拢、不交错可知,KClO3被还原为C1O2,HCl被氧化为C12,所以氯气只是氧化产物不是还原产物,故D错误;
故选A.
B、1mol氧气在反应中得到的电子数取决于反应后氧元素的价态,如果反应后氧元素变为-2价,则得4mol电子,如果变为-1价,则得2mol电子,故B错误;
C、Na2O2与H2O的反应为歧化反应:2Na2O2+2H2O=4NaOH+O2↑此反应中,2molNa2O2转移2mol电子,故1molNa2O2转移1mol电子,故C错误;
D、该反应中氧化剂是氯酸钾、浓盐酸是还原剂,根据在归中反应中化合价只靠拢、不交错可知,KClO3被还原为C1O2,HCl被氧化为C12,所以氯气只是氧化产物不是还原产物,故D错误;
故选A.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、用加热法可除去Na2CO3中的NaHCO3 |
| B、Na2CO3的热稳定性大于NaHCO3 |
| C、可用石灰水区分Na2CO3与NaHCO3溶液 |
| D、小苏打可中和胃酸、热纯碱可除去油污 |
下列说法不正确的是( )
| A、云、烟、雾等均能产生丁达尔现象 |
| B、开发氢能、太阳能、风能、生物质能等新型能源是践行低碳生活的有效途径 |
| C、“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关 |
| D、用脱硫处理的煤代替原煤做燃料可以有效减少空气中CO2气体的含量 |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、常温常压下,8g O2含有0.5 NA个电子 |
| B、0.1mol/L NaOH溶液中含有OH一的数目为0.1 NA |
| C、标准状况下,22.4L盐酸含有NA个HCl分子 |
| D、常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA |
下列方程式正确的是( )
| A、NaHSO3=Na++H++SO32- |
| B、BaSO4?Ba2++SO42- |
| C、S2-+2H2O?H2S+2OH- |
| D、HCl+H2O=H3O++Cl- |
下列反应的离子方程式中,错误的是( )
| A、用稀硫酸清除铁锈:Fe2O3+6H+=2Fe3++3H2O |
| B、铜粉放入硝酸银溶液里:Cu+Ag+=Cu2++Ag |
| C、用盐酸清除水垢CaCO3+2H+=Ca2++CO2↑+H2O |
| D、Fe跟稀硫酸反应:Fe+2H+=Fe2++H2↑ |
下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A、碱 纯碱 NaOH |
| B、酸性氧化物 干冰 CO |
| C、酸 硫酸 H2S |
| D、盐 纯碱 Na2CO32 |