题目内容
把12.8g的Cu放入足量的浓硝酸中,至Cu完全反应完.求:
(1)参加反应的硝酸的物质的量;
(2)生成的NO2在标准状况下的体积.
(1)参加反应的硝酸的物质的量;
(2)生成的NO2在标准状况下的体积.
考点:化学方程式的有关计算
专题:计算题
分析:(1)铜和浓硝酸反应生成硝酸铜和二氧化氮,根据铜和浓硝酸之间的关系式计算参加反应的浓硝酸的物质的量;
(2)根据铜和二氧化氮之间的关系式计算二氧化氮气体体积.
(2)根据铜和二氧化氮之间的关系式计算二氧化氮气体体积.
解答:
解:(1)n(Cu)=
=0.2mol,
设参加反应的浓硝酸的物质的量为x,
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
1mol 4mol
0.2mol x
1mol:4mol=0.2mol:x
x=
=0.8mol,
答:参加反应的浓硝酸的物质的量为0.8mol;
(2)设生成二氧化氮气体体积为y,
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
1mol 44.8L
0.2mol y
1mol:44.8L=0.2mol:y
y=
=8.96L,
答:生成的NO2在标准状况下的体积为8.96L.
| 12.8g |
| 64g/mol |
设参加反应的浓硝酸的物质的量为x,
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
1mol 4mol
0.2mol x
1mol:4mol=0.2mol:x
x=
| 4mol×0.2mol |
| 1mol |
答:参加反应的浓硝酸的物质的量为0.8mol;
(2)设生成二氧化氮气体体积为y,
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
1mol 44.8L
0.2mol y
1mol:44.8L=0.2mol:y
y=
| 44.8L×0.2mol |
| 1mol |
答:生成的NO2在标准状况下的体积为8.96L.
点评:本题考查了根据方程式进行计算,正确书写方程式是解本题关键,再结合物质之间的关系式分析解答,(2)题也可以根据转移电子相等进行计算,难度不大.

练习册系列答案
相关题目
下列离子方程式的书写正确的是( )
| A、SiO2与NaOH溶液反应:SiO2+2Na++2OH-=Na2SiO3+H2O |
| B、浓烧碱溶液中加入铝片:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
| C、铁和稀硝酸反应:Fe+2H+=Fe2++H2↑ |
| D、Cl2通入水中:Cl2+H2O=2H++Cl-+ClO- |

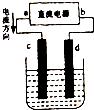 图是电解CuCl2溶液的装置,其中c、d为石墨电极.
图是电解CuCl2溶液的装置,其中c、d为石墨电极. 已知25℃、101kPa下,氢气、甲烷和葡萄糖C6H12O6(S)的燃烧热依次为285.8kJ/mol、890.3kJ/mol、2800kJ/mol.
已知25℃、101kPa下,氢气、甲烷和葡萄糖C6H12O6(S)的燃烧热依次为285.8kJ/mol、890.3kJ/mol、2800kJ/mol.