��Ŀ����
SO2��CO��NO���dz����Ĵ�����Ⱦ��
��1����ҵ���ó���SO2��ȥCO��������ΪS��CO2
��֪��S��s��+O2��g��=SO2��g����H=akJ?mol-1
CO��g��+
O2��g��=CO2��g����H=2akJ?mol-1
��ӦSO2��g��+2CO��g��=S��s��+2CO2��g���ġ�H= kJ?mol-1
��2��������������ͬ���ܱ������з�����Ӧ��2S2��g��+O2��g��?2SO3��g���ֱ���SO2��ƽ��ת�����ڲ�ͬѹǿ���¶��µı仯������ͼ1��ʾ����
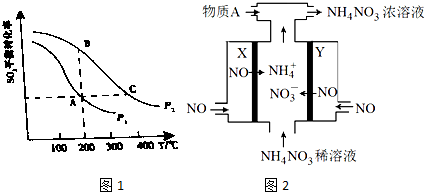
��A��B������ڵķ�Ӧ����vA vB���������������=����
��B��C������ڵĻ�ѧƽ�ⳣ����KB KC���������������=����
��3��25��ʱ����100mL0.1mol?L-1��NaOH��Һ����SO2������Һ��c��Na+��=c��HSO3-��+2��SO32-����Һ�� �ԣ���ᡱ����������С�����Һ��c��HSO3-��= mol?L-1
��4����֪�����NO2�Ʊ�NH4NO3���乤��ԭ����ͼ2��ʾ
�������缫��ӦʽΪ
��Ϊʹ������ȫ��ת��ΪNH4NO3���貹������A����A�Ļ�ѧʽΪ ��
��1����ҵ���ó���SO2��ȥCO��������ΪS��CO2
��֪��S��s��+O2��g��=SO2��g����H=akJ?mol-1
CO��g��+
| 1 |
| 2 |
��ӦSO2��g��+2CO��g��=S��s��+2CO2��g���ġ�H=
��2��������������ͬ���ܱ������з�����Ӧ��2S2��g��+O2��g��?2SO3��g���ֱ���SO2��ƽ��ת�����ڲ�ͬѹǿ���¶��µı仯������ͼ1��ʾ����

��A��B������ڵķ�Ӧ����vA
��B��C������ڵĻ�ѧƽ�ⳣ����KB
��3��25��ʱ����100mL0.1mol?L-1��NaOH��Һ����SO2������Һ��c��Na+��=c��HSO3-��+2��SO32-����Һ��
��4����֪�����NO2�Ʊ�NH4NO3���乤��ԭ����ͼ2��ʾ
�������缫��ӦʽΪ
��Ϊʹ������ȫ��ת��ΪNH4NO3���貹������A����A�Ļ�ѧʽΪ
���㣺ת�������¶ȡ�ѹǿ�ı仯����,�ø�˹���ɽ����йط�Ӧ�ȵļ���,���ԭ��
ר�⣺
��������1�������Ȼ�ѧ����ʽ��˹���ɼ��������Ȼ�ѧ����ʽ��
��2����ͼ�������֪AB���㣬�¶���ͬ����������ת����A��B��˵��B��ѹǿ����A���ѹǿ��P1��P2�����Ӱ�췴Ӧ�������ط����жϣ�
��B��C��������ѹǿ��ͬ�����µ�ƽ�⣬�¶Ȳ�ͬƽ�ⳣ����ͬ��ͼ�������֪B���������ת���ʴ���C��ת���ʣ�˵������ƽ��������У���Ӧ�Ƿ��ȷ�Ӧ���ݴ˷����жϣ�
��3��������Һ�е���غ�����жϣ�����ƽ�ⳣ������������������ӵ�Ũ�ȣ�
��4����ҵ�ϵ��NO2�Ʊ� NH4NO3����װ��ͼ��֪��������������Ӧ��NO2����������NO3-������������ԭ��Ӧ��NO2����ԭ����NH4+��������ӦΪNO2-e-+H2O=NO3-+2H+��������ӦΪ��NO2+7e-+8H+=NH4++2H2O����ϵ缫����ʽ�����⣮
��2����ͼ�������֪AB���㣬�¶���ͬ����������ת����A��B��˵��B��ѹǿ����A���ѹǿ��P1��P2�����Ӱ�췴Ӧ�������ط����жϣ�
��B��C��������ѹǿ��ͬ�����µ�ƽ�⣬�¶Ȳ�ͬƽ�ⳣ����ͬ��ͼ�������֪B���������ת���ʴ���C��ת���ʣ�˵������ƽ��������У���Ӧ�Ƿ��ȷ�Ӧ���ݴ˷����жϣ�
��3��������Һ�е���غ�����жϣ�����ƽ�ⳣ������������������ӵ�Ũ�ȣ�
��4����ҵ�ϵ��NO2�Ʊ� NH4NO3����װ��ͼ��֪��������������Ӧ��NO2����������NO3-������������ԭ��Ӧ��NO2����ԭ����NH4+��������ӦΪNO2-e-+H2O=NO3-+2H+��������ӦΪ��NO2+7e-+8H+=NH4++2H2O����ϵ缫����ʽ�����⣮
���
�⣺��1�������Ȼ�ѧ����ʽ��˹���ɼ��������Ȼ�ѧ����ʽ��
��ҵ�ϳ���SO2��ȥCO��������ΪS��CO2��
��֪����S��s��+O2��g��=SO2��g����H=a kJ?mol-1
��CO��g��+
O2��g��=CO2��g����H=b kJ?mol-1
���ݸ�˹���ɢڡ�2-�ٵõ�����ӦSO2��g��+2CO��g��=S��s��+2CO2��g����H=��2b-a��KJ/mol��
�ʴ�Ϊ��2b-a��
��2����ͼ�������֪AB���㣬�¶���ͬ����������ת����A��B��˵��B��ѹǿ����A���ѹǿ��P1��P2�����Ӱ�췴Ӧ�������ط����жϣ�A�㷴Ӧ����С��B��ķ�Ӧ���ʣ�
�ʴ�Ϊ������
��B��C��������ѹǿ��ͬ�����µ�ƽ�⣬�¶Ȳ�ͬƽ�ⳣ����ͬ��ͼ�������֪B���������ת���ʴ���C��ת���ʣ�˵������ƽ��������У���Ӧ�Ƿ��ȷ�Ӧ��B��ƽ�ⳣ������C�㣻
�ʴ�Ϊ������
��3��������Һ�е���غ�����жϣ���Һ�д��ڵ���غ㣺c��H+��+c��Na+��=c��HSO3-��+2��SO32-��+c��OH-����ʱ��c��Na+��=c��HSO3-��+2��SO32-����������Һ�����ԣ�����ƽ�ⳣ������������������ӵ�Ũ�ȣ�H2SO3�ĵ���ƽ�ⳣ��Ka1=1��10-2mol?L-1��H2SO3?HSO3-+H+��
c��Na+��=c��HSO3-��+2��SO32-��=0.1mol/L ��
Ka2=
=2��10-7��c��H+��=10-7mol/L �ڣ�
����٢ڵõ�c��HSO3-��=0.02mol/L��
�ʴ�Ϊ���У�0.02��
��4���ٵ��NO2�Ʊ�NH4NO3��������ӦΪ��NO2-e-+H2O=NO3-+2H+��������ӦΪ��NO2+7e-+8H+=NH4++2H2O���ʴ�Ϊ��NO2-e-+H2O=NO3-+2H+��
�ڴ�������Ӧ�ɿ�����Ҫʹ��ʧ�����غ㣬����������NO3-�����ʵ�����������������NH4+�����ʵ������ܷ�Ӧ����ʽΪ��8NO2+5H2O
NH4NO3+6HNO3�������Ҫʹ������ȫ��ת��ΪNH4NO3���貹��NH3���ʴ�Ϊ��NH3��
��ҵ�ϳ���SO2��ȥCO��������ΪS��CO2��
��֪����S��s��+O2��g��=SO2��g����H=a kJ?mol-1
��CO��g��+
| 1 |
| 2 |
���ݸ�˹���ɢڡ�2-�ٵõ�����ӦSO2��g��+2CO��g��=S��s��+2CO2��g����H=��2b-a��KJ/mol��
�ʴ�Ϊ��2b-a��
��2����ͼ�������֪AB���㣬�¶���ͬ����������ת����A��B��˵��B��ѹǿ����A���ѹǿ��P1��P2�����Ӱ�췴Ӧ�������ط����жϣ�A�㷴Ӧ����С��B��ķ�Ӧ���ʣ�
�ʴ�Ϊ������
��B��C��������ѹǿ��ͬ�����µ�ƽ�⣬�¶Ȳ�ͬƽ�ⳣ����ͬ��ͼ�������֪B���������ת���ʴ���C��ת���ʣ�˵������ƽ��������У���Ӧ�Ƿ��ȷ�Ӧ��B��ƽ�ⳣ������C�㣻
�ʴ�Ϊ������
��3��������Һ�е���غ�����жϣ���Һ�д��ڵ���غ㣺c��H+��+c��Na+��=c��HSO3-��+2��SO32-��+c��OH-����ʱ��c��Na+��=c��HSO3-��+2��SO32-����������Һ�����ԣ�����ƽ�ⳣ������������������ӵ�Ũ�ȣ�H2SO3�ĵ���ƽ�ⳣ��Ka1=1��10-2mol?L-1��H2SO3?HSO3-+H+��
c��Na+��=c��HSO3-��+2��SO32-��=0.1mol/L ��
Ka2=
| c(SO32-)c(H+) |
| c(HSO3-) |
����٢ڵõ�c��HSO3-��=0.02mol/L��
�ʴ�Ϊ���У�0.02��
��4���ٵ��NO2�Ʊ�NH4NO3��������ӦΪ��NO2-e-+H2O=NO3-+2H+��������ӦΪ��NO2+7e-+8H+=NH4++2H2O���ʴ�Ϊ��NO2-e-+H2O=NO3-+2H+��
�ڴ�������Ӧ�ɿ�����Ҫʹ��ʧ�����غ㣬����������NO3-�����ʵ�����������������NH4+�����ʵ������ܷ�Ӧ����ʽΪ��8NO2+5H2O
| ||
���������⿼�����Ȼ�ѧ����ʽ��˹���ɼ��㣬ͼ������жϣ���ѧƽ��Ӱ�����ص�����Ӧ�ã�������ʵ���ƽ��͵������Һ�е���غ�ķ��������ջ����ǹؼ�����Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
���з�Ӧ�У���Ԫ�ر��������ǣ�������
A��2KClO3
| ||||
B��2P+5Cl2
| ||||
C��MnO2+4HCl��Ũ��
| ||||
D��H2+Cl2
|
Ҫ�����ʵ��֤��ij���ε�ˮ�������ȵģ�����λͬѧ�ֱ��������»ش�������ȷ���ǣ�������
| A����ͬѧ��������茶�������ˮ����ˮ���½���˵�������ˮ�������ȵ� |
| B����ͬѧ���ڴ�����Һ�м���̼����立�ĩ������Һ�¶��½���˵������ˮ�������ȵ� |
| C����ͬѧ���ڴ�������Һ�м�������ƾ��壬����Һ�¶��½���˵������ˮ�������ȵ� |
| D����ͬѧ���ڴ�������Һ�е����̪��Һ�����Ⱥ�����ɫ���˵������ˮ�������ȵ� |
���������У����ܷ�����ȥ��Ӧ���ǣ�������
A�� |
| B��CH2 CH2Br2 |
C�� |
| D��CH2ClCH2CH3 |
���з�Ӧ�У����ڼӳɷ�Ӧ���ǣ�������
| A��CH3Cl+Cl2��CH2Cl2+HCl | |||
| B��CH2=CH2+HO-H��HOCH2-CH3 | |||
C��CH3COOCH2CH3+H2O
| |||
D�� +Br2 +Br2
 +HBr +HBr |
����˵����ȷ���ǣ�������
��Ư�۵���Ч�ɷ����Ȼ��ƺʹ�����Ƣ�pH��5.6��7.0֮�����ˮͨ����Ϊ�����ʹ�ö�����������ʳƷ�����彡��������ʹ������������ˮ�����������ɶ������к����л��Ȼ��
��Ư�۵���Ч�ɷ����Ȼ��ƺʹ�����Ƣ�pH��5.6��7.0֮�����ˮͨ����Ϊ�����ʹ�ö�����������ʳƷ�����彡��������ʹ������������ˮ�����������ɶ������к����л��Ȼ��
| A���٢ڢ� | B���ۢ� |
| C���٢ۢ� | D���٢ڢ� |
���з�Ӧ�ﵽƽ����»���ѹ��ƽ�ⶼ������Ӧ�����ƶ����ǣ�������
| A��2NH3��g��?3H2��g��+N2��g������H��0 |
| B��3O2��g��?2O3��g������H��0 |
| C��H2��g��+I2��g��?2HI��g������H��0 |
| D��2NO2��g��?N2O4��g������H��0 |
����Խ�ͣ�����Խ�ȶ�����Ӧ��ʯī�����ʯ�����ȷ�Ӧ���ɴ˿�֪��������
| A��ʯī�Ƚ��ʯ���ȶ� |
| B��ʯī�ͽ��ʯ�����ת�� |
| C�����ʯ��ʯī���ȶ� |
| D��ʯī�ͽ��ʯ���ܻ���ת�� |
 ��ʾ
��ʾ