题目内容
【题目】分实验室需要450 mL 1.0 mol·L-1的硫酸溶液,某小组的同学设计如下实验步骤并依此进行配制,请回答相关问题。(已知所用98%浓硫酸的密度为1.84 g/mL)
①计算需98%的浓硫酸的体积;
②在烧杯中将浓硫酸稀释;
③接着将稀释后的硫酸转移到容量瓶中;
④洗涤烧杯和玻璃棒3次,并将洗涤液转移到容量瓶中;
⑤定容;
⑥摇匀。
(1)该实验中选用的定量仪器,除量筒外,还有________________。
(2)该实验应该用(多大规格)_____ ______的量筒(可供选择的量筒规格为10 mL、15 mL、20 mL、50 mL和100 mL),量取___________mL 98%的浓硫酸。
(3)①在配制过程中,如果没有洗涤烧杯和玻璃棒,其他操作都正确,那么所配溶液的实际浓度将_____________(填“偏大、偏小、无影响”)
②某同学转移溶液的操作如图所示,该同学操作中的错误是 。
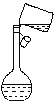
③若用胶头滴管定容时,不小心滴水滴过了刻度线,你认为应该采取的处理方法是: 。
④下列操作中,可能造成所配制溶液的浓度偏高的是 (填选项)。
a.溶解后没有冷却至室温就将液体转移至容量瓶中
b.定容时,俯视刻度线
c.洗涤后的容量瓶中残留少量蒸馏水
d.用量筒量取浓硫酸,读数时仰视刻度线
【答案】(1)500 mL容量瓶
(2)50 mL;27.2(小数点后必须有一位小数)
(3)①偏小;②没有使用玻璃棒引流;③重新配制;④ a b d
【解析】试题分析:(1)实验室没有450 mL的容量瓶,需要450 mL 1.0 mol·L-1的硫酸溶液,应该选用500 mL的容量瓶,因此该实验中选用的定量仪器,除量筒外,还有500 mL容量瓶,故答案为:500 mL容量瓶;
(2) 质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度为c(浓硫酸)=![]() =
=![]() =18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=1mol/L×0.5L,得V=0.0272L=27.2mL,选取的量筒规格应该等于或大于量取溶液体积,故选50mL量筒;故答案为:50 mL;27.2;
=18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=1mol/L×0.5L,得V=0.0272L=27.2mL,选取的量筒规格应该等于或大于量取溶液体积,故选50mL量筒;故答案为:50 mL;27.2;
(3)①在配制过程中,如果没有洗涤烧杯和玻璃棒,导致溶质的物质的量偏少,浓度偏小,故答案为:偏小;
②根据图示,操作中的错误有,故答案为:没有使用玻璃棒引流;
③若用胶头滴管定容时,不小心滴水滴过了刻度线,应该重新配制,故答案为:重新配制;
④a.溶解后没有冷却至室温就将液体转移至容量瓶中,导致溶液的体积偏小,浓度偏大,正确;b.定容时,俯视刻度线,导致溶液的体积偏小,浓度偏大,正确;c.洗涤后的容量瓶中残留少量蒸馏水对结果没有影响,错误;d.用量筒量取浓硫酸,读数时仰视刻度线,导致浓硫酸的体积偏大,溶质的物质的量偏多,浓度偏大,正确;故选a b d。





