题目内容
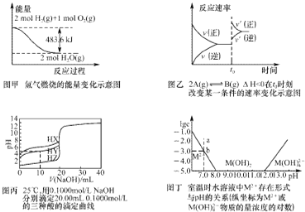
【题目】25℃时,二元弱酸H2R的pKa1=1.85,pKa2=7.45(已知pKa=-lgKa)。在此温度下向20mL0.1molL-1H2R溶液中滴加0.1molL-1的NaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示。

下列有关说法正确的是( )
A. a点所示溶液中:c(H2R)+c(HR-)+c(R2-)=0.1molL-1
B. b点所示溶液中:c(Na+)>c(HR-)>c(H2R)>c(R2-)
C. c点溶液中水电离程度大于d点溶液
D. d点所示溶液中:c(Na+)>c(R2-)>c(HR-)
【答案】D
【解析】
A.a点溶液体积是原来的1.5倍,则含有R元素的微粒浓度是原来的![]() ,根据物料守恒得c(H2R)+c(HR-)+c(R2-)=
,根据物料守恒得c(H2R)+c(HR-)+c(R2-)=![]() molL-1,故A错误;
molL-1,故A错误;
B.b点二者恰好完全反应生成NaHR,溶液呈酸性,说明HR-的电离程度大于水解程度,但其水解和电离程度都较小,钠离子不水解,所以离子微粒浓度大小顺序是c(Na+)>c(HR-)>c(R2-)>c(H2R),故B错误;
C.c点是浓度相等的NaHR和Na2R的混合溶液,NaHR抑制水的电离,Na2R促进水的电离;d点是Na2R溶液,对水的电离有促进作用,故d点的水的电离程度大于c点,故C错误;
D.d点溶液中溶质为Na2R,R2-水解但程度较小,所以存在c(Na+)>c(R2-)>c(HR-),故D正确;
答案选D。

【题目】实验室模拟合成![]() 和CH3CH2CH2Br的方法如图1。
和CH3CH2CH2Br的方法如图1。
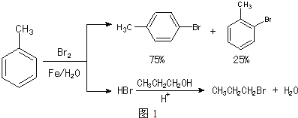
已知:甲苯和液溴在有少量水存在时也能反应(如图2):

实验室模拟合成对溴甲苯和1-溴丙烷的流程和相关数据如表:
物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 | 对溴甲苯 | 邻溴甲苯 |
沸点(℃) | 110.8 | 97.2 | 71 | 184.3 | 181.7 |
(1)实验室存放液溴的试剂瓶需密闭,同时瓶中要加入____,以减少溴的挥发.写出甲苯和液溴反应生成对溴甲苯的化学方程式___。
(2)反应装置如图3所示:
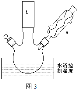
①图中玻璃仪器a的名称是____,方块b中为某玻璃仪器,其名称是___。
②三颈烧瓶中开始加入了甲苯、铁粉和水。加入的适量水的作用是:易于控制温度和____,加热搅拌操作中加入浓硫酸,完成1-丙醇的取代反应,浓硫酸的作用是____。
(3)操作I的名称是___,操作Ⅲ的名称是___。
【题目】如下表所示为元素周期表的一部分,参照元素①~⑦在表中的位置,请回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(1)③④⑦的原子半径由大到小的顺序为____(用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为____(用酸的化学式表示)。
(3)②④两种元素按原子个数之比为1:1组成的化合物的电子式____。
(4)①②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式___。
(5)表中⑤的单质和④的最高价氧化物水化物反应的化学方程式为____。