题目内容
【题目】氮元素有着多变价态和种类繁多的化合物,在工农业生产中有重要的应用。
![]() 同周期元素中,比氮元素的第一电离能大的元素共有________种。
同周期元素中,比氮元素的第一电离能大的元素共有________种。
![]() 与汞共热可制得
与汞共热可制得![]() 。
。
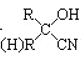
![]() 的几何构型为________,
的几何构型为________,![]() 中
中![]() 键和
键和![]() 键的个数比为________。
键的个数比为________。
![]() 已知汞位于第六周期,与锌同族。基态汞原子的价电子排布式为______。
已知汞位于第六周期,与锌同族。基态汞原子的价电子排布式为______。
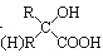
![]() 分子中B原子的杂化轨道类型为_______,该分子的熔沸点比乙烷高,原因是________________。
分子中B原子的杂化轨道类型为_______,该分子的熔沸点比乙烷高,原因是________________。
![]() 由B、N、F元素组成的离子化合物中,B、N、F原子的个数比为
由B、N、F元素组成的离子化合物中,B、N、F原子的个数比为![]() ,其阴阳离子是等电子体,该化合物中的阴离子是________
,其阴阳离子是等电子体,该化合物中的阴离子是________![]() 填离子符号
填离子符号![]() 。
。
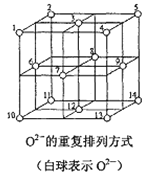
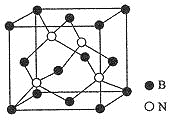
![]() 氮化硼晶体结构如图所示:
氮化硼晶体结构如图所示:
![]() 该晶体中含有的微粒间作用力为________。
该晶体中含有的微粒间作用力为________。
![]() 图中N原子的坐标参数为
图中N原子的坐标参数为![]() ;
;![]() ;
;![]() ;________。
;________。
![]() 已知BN晶胞中相邻且最近的硼、氮原子的核间距为acm,
已知BN晶胞中相邻且最近的硼、氮原子的核间距为acm,![]() 为阿伏加德罗常数的值,其密度为________
为阿伏加德罗常数的值,其密度为________![]() 列出计算式即可
列出计算式即可![]() 。
。
【答案】![]() 三角锥形
三角锥形 ![]()
![]()
![]()
![]()
![]() 共价键
共价键![]() 或极性共价键
或极性共价键![]()
![]()
![]()
【解析】
(1)同一周期元素,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素;
![]() 分子与
分子与![]() 分子结构相似;
分子结构相似;![]() 的结构式为
的结构式为![]() ;
;
![]() 汞位于第六周期,与锌同族,已知锌为第四周期元素,价电子排布式为
汞位于第六周期,与锌同族,已知锌为第四周期元素,价电子排布式为![]() ;
;
![]() 氨硼烷
氨硼烷![]()
![]() 分子中
分子中![]() 间是配位键,B原子的2s轨道与3个p轨道杂化,形成4个共价键;
间是配位键,B原子的2s轨道与3个p轨道杂化,形成4个共价键;![]() 分子中存在N、H元素,分子间存在氢键;
分子中存在N、H元素,分子间存在氢键;
![]() 形成的化合物中F一定是
形成的化合物中F一定是![]() 价,B最高价只能是
价,B最高价只能是![]() 价,所以N元素一定是
价,所以N元素一定是![]() 价,由于形成的是离子化合物,且阴阳离子为等电子体;
价,由于形成的是离子化合物,且阴阳离子为等电子体;
![]() 结合晶体中4个N原子所处的位置分析;
结合晶体中4个N原子所处的位置分析;
![]() 先确定晶胞的组成和质量,再结合密度公式
先确定晶胞的组成和质量,再结合密度公式![]() 计算。
计算。
![]() 同周期自左而右元素的第一电离能呈增大趋势,但氮元素的2p能级有3个电子,处于半满稳定状态,氮元素的第一电离能高于同周期相邻元素,比氮元素的第一电离能大的元素为F和Ne;共有2种;
同周期自左而右元素的第一电离能呈增大趋势,但氮元素的2p能级有3个电子,处于半满稳定状态,氮元素的第一电离能高于同周期相邻元素,比氮元素的第一电离能大的元素为F和Ne;共有2种;
![]() 分子与
分子与![]() 分子结构相似,氮原子含有3个共价键和一个孤电子对,所以空间构型是三角锥形;
分子结构相似,氮原子含有3个共价键和一个孤电子对,所以空间构型是三角锥形;![]() 的结构式为
的结构式为![]() ,根据单键就是
,根据单键就是![]() 键,双键的一根是
键,双键的一根是![]() 键、另一根是
键、另一根是![]() 键,该分子中含3个
键,该分子中含3个![]() 键和1个
键和1个![]() 键,比值为
键,比值为![]() ;
;
![]() 汞位于第六周期,与锌同族,已知锌为第四周期元素,价电子排布式为
汞位于第六周期,与锌同族,已知锌为第四周期元素,价电子排布式为![]() ,则基态汞原子的价电子排布式为
,则基态汞原子的价电子排布式为![]() ;
;
![]() 氨硼烷
氨硼烷![]()
![]() 分子中
分子中![]() 间是配位键,B原子的2s轨道与3个p轨道杂化,形成4个共价键,所以采取
间是配位键,B原子的2s轨道与3个p轨道杂化,形成4个共价键,所以采取![]() 杂化;
杂化;![]() 分子中存在N、H元素,分子间存在氢键,乙烷中无氢键,氢键的作用力比分子间作用力大,所以该分子的熔沸点比乙烷高;
分子中存在N、H元素,分子间存在氢键,乙烷中无氢键,氢键的作用力比分子间作用力大,所以该分子的熔沸点比乙烷高;
![]() 形成的化合物中F一定是
形成的化合物中F一定是![]() 价,B最高价只能是
价,B最高价只能是![]() 价,所以N元素一定是
价,所以N元素一定是![]() 价,由于形成的是离子化合物,且阴阳离子为等电子体,可推出阳离子是
价,由于形成的是离子化合物,且阴阳离子为等电子体,可推出阳离子是![]() ,阴离子是
,阴离子是![]() ;
;
![]() 氮化硼是原子晶体,B原子和N原子以极性共价键结合;
氮化硼是原子晶体,B原子和N原子以极性共价键结合;
![]() 图中N原子的坐标参数为
图中N原子的坐标参数为![]() ;
;![]() ;
;![]() ,可知晶胞边长为1,4个N原子分别晶胞的两条对角线上,则结合晶体中4个N原子所处的位置可知另一个原子的坐标参数为:
,可知晶胞边长为1,4个N原子分别晶胞的两条对角线上,则结合晶体中4个N原子所处的位置可知另一个原子的坐标参数为:![]() ;
;
![]() 晶胞中B原子个数为8×
晶胞中B原子个数为8×![]() +6×
+6×![]() =4,含有N原子个数为4,则晶胞中含4个BN,设晶胞边长为x,则体对角线长度为
=4,含有N原子个数为4,则晶胞中含4个BN,设晶胞边长为x,则体对角线长度为![]() ,即
,即![]() ,再由1mol晶胞中含4molBN,可计算晶胞的密度为
,再由1mol晶胞中含4molBN,可计算晶胞的密度为![]() 。
。

【题目】已知常温下,几种难溶电解质的溶度积(Ksp):
化学式 | Mg(OH)2 | MgF2 | Fe(OH)3 | AgCl | Cu(OH)2 | Ag2CrO4 |
溶度积 | 5.6×10-12 | 7.4×10-11 | 4 .0×10-38 | 1.8×10-10 | 2.2×10-20 | 2.0×10-12 |
下列说法不正确的是( )
A. 在Mg(OH)2 的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B. 在Mg(OH)2 的悬浊液中加入NaF 溶液液后,Mg(OH)2 不可能转化为MgF2
C. CuCl2溶液中混入了一定量的FeCl3溶液,可以通过向溶液中加入CuO的方法,调整溶液的pH,除去Fe3+杂质
D. 向浓度均为1×10-3mol/L 的KCl 和K2CrO4混合液中滴加1×10-3mo/LAgNO3溶液,Cl-先形成沉淀