题目内容
16.将一定量的有机物A溶于烧碱溶液中,滴入酚酞试液呈红色,煮沸5分钟后,溶液红色变浅,再向其中加入盐酸,显酸性,并析出白色晶体;取少量上述晶体放到FeCl3溶液中,溶液呈紫色.则有机物A可能是( )| A. |  | B. |  | C. | 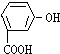 | D. | 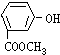 |
分析 取少量晶体放在FeCl3溶液中,溶液呈现紫色,说明有机物中含有酚羟基,煮沸5min后溶液颜色变浅,说明有机物中含有在碱性条件下水解的官能团,以此解答该题.
解答 解:遇FeCl3溶液呈紫色,说明有机物中含有酚羟基,A、B错误,煮沸后颜色变浅说明酯发生了碱性水解,则C错误,只有D符合,
故选D.
点评 本题考查有机物的推断,题目难度不大,注意根据有机物的性质推断可能具有的官能团.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
1.(1)下列物质中,属于弱电解质的是(填序号,下同)⑦⑨,属于非电解质的是④⑥⑩;
①亚硫酸溶液 ②次氯酸钠 ③氯化氢气体 ④蔗糖 ⑤硫酸钡
⑥氨气 ⑦冰醋酸 ⑧硫酸氢钠固体 ⑨氢氧化铝 ⑩NO2
(2)甲、乙两瓶氨水的浓度分别为1mol•L-1、0.1mol•L-1,则c(OH-)甲:c(OH-)乙小于10(填“大于”、“等于”或“小于”);
(3)下表数据均在相同温度下测得,由此可知三种酸的酸性由强到弱的顺序为HZ>HY>HX;
(4)NO2与NO之间存在如下可逆反应:2NO2?2NO+O2.T℃时,在一恒容密闭容器中充入适量NO2,反应达到平衡状态的标志是①③④⑤.
①混合气体的颜色不再改变的状态 ②混合气体的密度不再改变的状态
③混合气体的压强不再改变的状态 ④混合气体的平均相对分子质量不再改变的状态
⑤C2(NO2)/[C2(NO)•C(O2)]的比值不再改变的状态.
①亚硫酸溶液 ②次氯酸钠 ③氯化氢气体 ④蔗糖 ⑤硫酸钡
⑥氨气 ⑦冰醋酸 ⑧硫酸氢钠固体 ⑨氢氧化铝 ⑩NO2
(2)甲、乙两瓶氨水的浓度分别为1mol•L-1、0.1mol•L-1,则c(OH-)甲:c(OH-)乙小于10(填“大于”、“等于”或“小于”);
(3)下表数据均在相同温度下测得,由此可知三种酸的酸性由强到弱的顺序为HZ>HY>HX;
| HX | HY | HZ | |
| 浓度 mol•L-1 | 0.1 0.5 | 1.0 1.5 | 2.0 2.5 |
| 电离度 | 0.3% 0.13% | 0.3% 0.24% | 0.5% 0.45% |
①混合气体的颜色不再改变的状态 ②混合气体的密度不再改变的状态
③混合气体的压强不再改变的状态 ④混合气体的平均相对分子质量不再改变的状态
⑤C2(NO2)/[C2(NO)•C(O2)]的比值不再改变的状态.
7.下列关于漂白粉的叙述正确的是( )
| A. | 漂白粉的有效成分是Ca(ClO)2和CaCl2 | |
| B. | 漂白粉在空气中久置后会变质 | |
| C. | 漂白粉的有效成分Ca(ClO)2不稳定,易分解 | |
| D. | 漂白粉的主要成分是CaCl2 |
4.下列叙述不正确的是( )
①分子内一定含有共价键 ②离子键就是阴、阳离子的静电引力③离子键只存在于化合物中 ④仅由非金属元素不可能形成离子化合物.⑤通常,活泼金属与活泼非金属形成离子化合物.
①分子内一定含有共价键 ②离子键就是阴、阳离子的静电引力③离子键只存在于化合物中 ④仅由非金属元素不可能形成离子化合物.⑤通常,活泼金属与活泼非金属形成离子化合物.
| A. | ①②④ | B. | ①②③④ | C. | ③④⑤ | D. | 全部都不正确 |
1.关于下列物质的结构或性质分析正确的是( )
| A. | CH2O和CO2分子中的中心原子均采用sp2杂化 | |
| B. | CH3SH 的相对分子质量比CH3OH大,因此前者的沸点高 | |
| C. | C6H6分子中含有6个σ键和1个大π键,C6H6是非极性分子 | |
| D. | 甲胺(分子式CH3NH2)的沸点比三甲胺[分子式(CH3)3N]的沸点高 |
8.下列离子方程式正确的是( )
| A. | Zn与稀H2SO4反应:Zn+H+═Zn2++H2↑ | |
| B. | Na2CO3溶液与足量盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| C. | Cl2与NaOH溶液反应:Cl2+2OH-═2Cl-+H2O | |
| D. | MgCl2溶液与过量氨水反应:Mg2++2OH-═Mg(OH)2↓ |
5.实验式相同,既不是同系物,又不是同分异构体的是( )
| A. | 1-丁烯和环己烷 | B. | 1-庚烯和3-甲基-1-丁烯 | ||
| C. | 1-氯丙烷和2-氯丙烷 | D. | 甲苯和乙苯 |
 置换反应的通式可表示为如图所示:请回答下列问题:
置换反应的通式可表示为如图所示:请回答下列问题: 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$