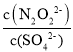��Ŀ����
����Ŀ��A��B��C��D��E��F��G���ֶ�����Ԫ�ص�ԭ�����������������н���һ��ϡ������Ԫ�ء�A��E������������ͬ������������Ԫ�ص�ԭ���У�A ԭ�ӵİ뾶��С��EԪ����ɫ��Ӧ��ɫΪ��ɫ��B��C��F��G�����ڱ������ڣ�B��Cͬ���ڣ�F��Gͬ����C��Fͬ���壬 CԪ���ǵؿ��к�������Ԫ�أ�A��C���γ����ֳ�����Һ̬������X��Y����Է�������X��Y����D�γɵķ���Ϊ��ԭ�ӷ��ӡ��ش����⣺
��1��GԪ��Ϊ______(��Ԫ�ط���)�� Y�ĵ���ʽΪ_______________��
��2��Һ̬������Y��ϡH2SO4�ữ��K2Cr2O7��Һ���ÿɲ���һ����ɫ��ȼ�����弰�����Ե�Cr2(SO4)3����÷�Ӧ�����ӷ���ʽΪ______________________________________��
��3����ij�ֽ�����������A��C��E��ɵĻ������ˮ��Һ��Ӧ������������ɳ���������д���÷�Ӧ�����ӷ���ʽ____________��ʹ������������ڵ�������________________��
��4��P��Q�������ʶ�����A��C��E��F����Ԫ����ɵ��Σ���ˮ��Һ�������ԣ������ʵ�����P��Qǡ����ȫ��Ӧ��д���÷�Ӧ�����ӷ���ʽ��_________________________���������ξ����еĻ�ѧ������Ϊ________________________��
��5����A��B��Ԫ���γɵĻ�����W����Ϊ����ƽ����е�ǿ��ԭ������֪һ��W���Ӻ�һ��Y�����ж�����18�����ӣ�0.5molҺ̬W������Һ̬Y��Ӧ������һ����ɫ��ζ��������B2��Һ̬X��д���÷�Ӧ�Ļ�ѧ����ʽΪ__________________________��
���𰸡�Cl ![]() 3H2O2+Cr2O72-+8H+=2Cr3++3O2��+7H2O 2Al+2OH-+2H2O=2A1O2-+3H2�� ������ᷢ����ը H++HSO3-=H2O+SO2�� ���Ӽ������ۼ� N2H4+2H2O2=N2��+4H2O
3H2O2+Cr2O72-+8H+=2Cr3++3O2��+7H2O 2Al+2OH-+2H2O=2A1O2-+3H2�� ������ᷢ����ը H++HSO3-=H2O+SO2�� ���Ӽ������ۼ� N2H4+2H2O2=N2��+4H2O
��������
A ԭ�ӵİ뾶��С������Ϊ��(H)��EԪ����ɫ��Ӧ��ɫΪ��ɫ������Ϊ��(Na)��CԪ���ǵؿ��к�������Ԫ�أ�����Ϊ��(O)��C��Fͬ���壬��FΪ��(S)��F��Gͬ������ԭ������F<G����GΪ��(Cl)��B��Cͬ������ԭ������B<C����BΪ��(N)��D�γɵķ���Ϊ��ԭ�ӷ��ӣ���ԭ����������C������Ϊ��(Ne)��A��C���γ����ֳ�����Һ̬������X��Y����Է�������X��Y������XΪH2O��YΪH2O2��
��1�������Ϸ�������ȷ��GԪ�أ�YΪH2O2��
��2��H2O2��ϡH2SO4�ữ��K2Cr2O7��Һ���ã�����O2��Cr2(SO4)3�ȡ�
��3��Al��NaOH��ˮ��Һ��Ӧ������H2�ȣ�H2��������ᷢ����ը��
��4��P��QΪNaHSO3��NaHSO4����ˮ��Һ�������ԣ����ߵ�Ħ��Ӧ���������ơ�ˮ�Ͷ�������
��5����H��N��ɵ�W���Ӻ���18�����ӣ����仯ѧʽΪN2H4����H2O2��Ӧ������N2��H2O��
��1�������Ϸ�����֪��GԪ��ΪCl��Y�ĵ���ʽΪ![]() ����Ϊ��Cl��
������Cl��![]() ��
��
��2��H2O2��ϡH2SO4�ữ��K2Cr2O7��Һ���ã�����O2��Cr2(SO4)3�ȣ��÷�Ӧ�����ӷ���ʽΪ3H2O2+Cr2O72-+8H+=2Cr3++3O2��+7H2O����Ϊ��3H2O2+Cr2O72-+8H+=2Cr3++3O2��+7H2O��
��3��Al��NaOH��ˮ��Һ��Ӧ������H2�ȣ��÷�Ӧ�����ӷ���ʽ2Al+2OH-+2H2O
=2A1O2-+3H2����ʹ������������ڵ�������������ᷢ����ը����Ϊ��2Al+2OH-+2H2O=2A1O2-+3H2����������ᷢ����ը��
��4��P��QΪNaHSO3��NaHSO4����ˮ��Һ�������ԣ����ߵ�Ħ��Ӧ���������ơ�ˮ�Ͷ������÷�Ӧ�����ӷ���ʽ��H++HSO3-=H2O+SO2�����������ξ����еĻ�ѧ������Ϊ���Ӽ������ۼ�����Ϊ��H++HSO3-=H2O+SO2�������Ӽ������ۼ���
��5����H��N��ɵ�W���Ӻ���18�����ӣ����仯ѧʽΪN2H4����H2O2��Ӧ������N2��H2O���÷�Ӧ�Ļ�ѧ����ʽΪN2H4+2H2O2=N2��+4H2O����Ϊ��N2H4+2H2O2=N2��+4H2O��

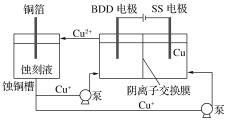
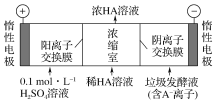
����Ŀ��������һ����Ҫ�Ĺ�ҵԭ�ϣ�Һ�ȴ��������е�˵�������£�
��װ | ��ƿ |
����Ҫ�� | Զ�������ĩ���������ࡢ�������ʣ�������������� |
й©���� | NaOH��NaHSO3��Һ���� |
���н�����ʵ�ķ���ʽ����ȷ����
A. ������������ˮ������Cl2 + H2O![]() 2H+ + Cl��+ ClO��
2H+ + Cl��+ ClO��
B. ��ⱥ��ʳ��ˮ��ȡCl2��2Cl�� +2H2O![]() 2OH��+ H2��+Cl2��
2OH��+ H2��+Cl2��
C. Ũ��ˮ����й¶���������������̣�8NH3 + 3Cl2 === 6 NH4Cl + N2
D. ������й©��������NaHSO3��Һ�����ã�HSO3��+ Cl2 + H2O === SO42��+ 3H+ + 2Cl��