题目内容
mg FeO、Fe2O3、CuO的混合物,加入120mL 1.0mol/L H2SO4溶液中完全溶解,向所得溶液中逐滴加入1.5mol/L NaOH溶液至刚出现沉淀时,消耗NaOH溶液40mL;将mg的混合物用CO气体加热还原,实验过程中耗去标准状况下的CO3.36升,得固体wg.则w的值为
- A.m-0.96
- B.m-1.44
- C.m-1.6
- D.m-2.4
B
分析:氧化物溶解于稀硫酸后,再向硫酸盐溶液中加氢氧化钠溶液,当刚出现沉淀时用去氢氧化钠,说明酸有剩余,根据氢氧化钠的物质的量计算剩余硫酸的物质的量;
除去剩余的硫酸就是与氧化物反应的硫酸,硫酸中氢离子和氧化物中的氧原子反应生成水,根据水的化学式知,和氧化物反应的硫酸的物质的量就等于氧原子的物质的量,CO还原氧化物得到的金属就等于氧化物的质量减去氧元素的质量.
解答:和硫酸反应的n(NaOH)=1.5mol/L×0.04L=0.06mol,硫酸和氢氧化钠反应的物质的量之比为1:2,所以能和氢氧化钠反应的硫酸的物质的量是0.03mol,则与金属氧化物反应的n(H2SO4)=1.0mol/L×0.12L-0.03mol=0.09mol,根据H2O的化学式知,硫酸和氧原子的物质的量之比为1:1,所以氧化物中n(O)=0.09mol,即氧原子的质量=16g/mol×0.09mol=1.44g,
CO还原金属氧化物得到的金属质量=金属氧化物的质量-氧原子的质量=mg-1.44g,所以W是m-1.44,
故选B.
点评:本题考查了有关混合物的计算,难度不大,明确反应过程中硫酸和氧原子的关系、金属氧化物和金属单质的关系是解本题的关键.
分析:氧化物溶解于稀硫酸后,再向硫酸盐溶液中加氢氧化钠溶液,当刚出现沉淀时用去氢氧化钠,说明酸有剩余,根据氢氧化钠的物质的量计算剩余硫酸的物质的量;
除去剩余的硫酸就是与氧化物反应的硫酸,硫酸中氢离子和氧化物中的氧原子反应生成水,根据水的化学式知,和氧化物反应的硫酸的物质的量就等于氧原子的物质的量,CO还原氧化物得到的金属就等于氧化物的质量减去氧元素的质量.
解答:和硫酸反应的n(NaOH)=1.5mol/L×0.04L=0.06mol,硫酸和氢氧化钠反应的物质的量之比为1:2,所以能和氢氧化钠反应的硫酸的物质的量是0.03mol,则与金属氧化物反应的n(H2SO4)=1.0mol/L×0.12L-0.03mol=0.09mol,根据H2O的化学式知,硫酸和氧原子的物质的量之比为1:1,所以氧化物中n(O)=0.09mol,即氧原子的质量=16g/mol×0.09mol=1.44g,
CO还原金属氧化物得到的金属质量=金属氧化物的质量-氧原子的质量=mg-1.44g,所以W是m-1.44,
故选B.
点评:本题考查了有关混合物的计算,难度不大,明确反应过程中硫酸和氧原子的关系、金属氧化物和金属单质的关系是解本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
(15分)活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO):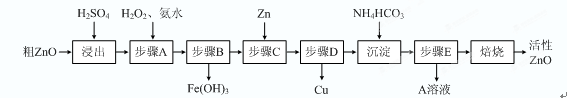
已知:几种离子生成氢氧化物沉淀时的pH如下表:
| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
⑴步骤A加H2O2发生反应的离子方程式是 ,该步骤需控制溶液pH的范围是 。
⑵ A溶液中主要含有的溶质是 。
⑶碱式碳酸锌经焙烧制得活性ZnO的反应△H>0,该反应能自发进行的原因是 。
⑷若经处理后的废水pH=8,此时Zn2+的浓度为 mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17)。
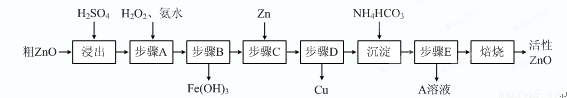
(15分)活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO):
已知:几种离子生成氢氧化物沉淀时的pH如下表:
|
待沉淀离子 |
Fe2+ |
Fe3+ |
Zn2+ |
Cu2+ |
|
开始沉淀时pH |
6.34 |
1.48 |
6.2 |
5.2 |
|
完全沉淀时pH |
9.7 |
3.2 |
8.0 |
6.4 |
请问答下列问题:
⑴ 步骤A加H2O2发生反应的离子方程式是 ,该步骤需控制溶液pH的范围是 。
⑵ A溶液中主要含有的溶质是 。
⑶ 碱式碳酸锌经焙烧制得活性ZnO的反应△H>0,该反应能自发进行的原因是 。
⑷ 若经处理后的废水pH=8,此时Zn2+的浓度为 mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17)。

 ·y
·y O)(注:X可以是分数),变废为宝。则控制空气适量的目的是 ,使铁氧体分离出来较简便的方法是 。假设处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O则复合氧化物(
O)(注:X可以是分数),变废为宝。则控制空气适量的目的是 ,使铁氧体分离出来较简便的方法是 。假设处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O则复合氧化物(
