题目内容
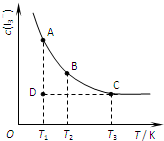 实验室中配制碘水,往往是将I2溶于KI溶液中,即可得到浓度较大的碘水,原因是发生了反应:I2(aq)+I-(aq)?I3-(aq).在反应的平衡体系中,c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态).下列说法正确的是( )
实验室中配制碘水,往往是将I2溶于KI溶液中,即可得到浓度较大的碘水,原因是发生了反应:I2(aq)+I-(aq)?I3-(aq).在反应的平衡体系中,c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态).下列说法正确的是( )| A、该反应的正反应为放热反应 | B、A状态与C状态的化学反应速率大小为v(A)>v(C) | C、D状态时,v正>v逆 | D、欲配制浓度较大的氯水,可将氯气通入氯化钾溶液中 |
分析:A、根据温度升高时平衡移动的方向判断反应的反应热;
B、根据A、C状态对应的温度,结合温度对化学反应速率的影响来判断反应速率关系;
C、根据D状态与平衡状态比较,判断反应方向进而得出反应速率关系;
D、根据平衡移动规律来回答判断.
B、根据A、C状态对应的温度,结合温度对化学反应速率的影响来判断反应速率关系;
C、根据D状态与平衡状态比较,判断反应方向进而得出反应速率关系;
D、根据平衡移动规律来回答判断.
解答:解:A、随着温度的不断升高,I3-的浓度逐渐的减小,说明反应向逆方向移动,I2(aq)+I-(aq) I3-(aq) 是一个放热反应,即△H<0,故A正确;
I3-(aq) 是一个放热反应,即△H<0,故A正确;
B、从图中可知,A点的温度比C点温度低,所以A点与C点的化学反应速率vA<vC,故B错误;
C、从图中可以看出D点并没有达到平衡状态,所以它要向A点移动,I3-的浓度应增加,平衡向正分析移动,所以v正>v逆,故C正确;
D、将氯气通入氯化钾溶液中,会发生类似碘单质的反应:Cl2(aq)+Cl-(aq)?Cl3-(aq).c(Cl3-)增大,则c(Cl2)减小,C(Cl-)减小,不能达到目的,故D错误.
故选AC.
 I3-(aq) 是一个放热反应,即△H<0,故A正确;
I3-(aq) 是一个放热反应,即△H<0,故A正确;B、从图中可知,A点的温度比C点温度低,所以A点与C点的化学反应速率vA<vC,故B错误;
C、从图中可以看出D点并没有达到平衡状态,所以它要向A点移动,I3-的浓度应增加,平衡向正分析移动,所以v正>v逆,故C正确;
D、将氯气通入氯化钾溶液中,会发生类似碘单质的反应:Cl2(aq)+Cl-(aq)?Cl3-(aq).c(Cl3-)增大,则c(Cl2)减小,C(Cl-)减小,不能达到目的,故D错误.
故选AC.
点评:本题考查化学平衡的移动和平衡常数的运用,注意化学平衡图象分析的一般方法来解答:一看面:看清图象中横坐标和纵坐标的含义;二看线:弄清图象中线的斜率或线走势的意义;三看点:明确曲线的起点、终点、交点及拐点等;四看是否需要辅助线.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
文献资料显示某地区的酸雨主要为硫酸型和盐酸型酸雨.某兴趣小组对酸雨进行实验研究.
(1)提出合理的假设:该酸雨中的溶质除H2SO4、HC1外,该小组同学根据硫酸型酸雨的形成过程,预测主要溶质还一定有 .
(2)设计实验方案验证以上假设.在答题卡上写出实验步骤、预期现象和结论.限选试剂及仪器:盐酸、硝酸、BaC12溶液、Ba(OH)2溶液、AgNO3溶液、紫色石蕊试液、品红溶液、烧杯、试管、胶头滴管.
(3)酸雨部分组成测定:
①标准溶液配制:实验室用1.000mol?L-1较浓的碘水配制250mL 0.02000mol?L-1的碘水溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需 .
②滴定:准确量取25.00mL该酸雨于锥形瓶中,加入几滴 溶液作指示剂,将0.02000mol?L-1碘水装入50mL酸式滴定管,滴定终点现象为 ,记录数据,重复滴定2次,平均消耗碘水VmL.
计算:被碘水氧化的物质的量浓度之和为 (只列出算式,不做运算)
(1)提出合理的假设:该酸雨中的溶质除H2SO4、HC1外,该小组同学根据硫酸型酸雨的形成过程,预测主要溶质还一定有
(2)设计实验方案验证以上假设.在答题卡上写出实验步骤、预期现象和结论.限选试剂及仪器:盐酸、硝酸、BaC12溶液、Ba(OH)2溶液、AgNO3溶液、紫色石蕊试液、品红溶液、烧杯、试管、胶头滴管.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量酸雨于A、B两支洁净试管中,待用 | 无明显现象 |
| 步骤2:往A试管中加入过量的Ba(OH)2溶液,静置,过滤 | 有白色沉淀 |
| 步骤3:取少量步骤2得到的滤渣加入过量盐酸 | 滤渣不能完全溶解,说明酸雨中含有硫酸 |
| 步骤4:取适量步骤2得到的滤液, |
|
| 步骤5:往B试管中加入 |
①标准溶液配制:实验室用1.000mol?L-1较浓的碘水配制250mL 0.02000mol?L-1的碘水溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需
②滴定:准确量取25.00mL该酸雨于锥形瓶中,加入几滴
计算:被碘水氧化的物质的量浓度之和为
 灼烧
灼烧