题目内容
(1)标准状况下:①0.3mol氨气 ②6.02×1022个CO2分子 ③7.3gHCl ④0.2molCH4.
体积最大的是______;密度最大的是______;质量最大的是______.(填序号)
(2)相同质量的SO2与SO3,其物质的量之比为______,氧元素的质量之比为______,原子总数之比为______.
解:(1)①0.3mol氨气,质量为0.3mol×17g/mol=5.1g,
②6.02×1022个CO2分子,物质的量为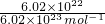 =0.1mol,质量为0.1mol×44g/mol=4.4g,
=0.1mol,质量为0.1mol×44g/mol=4.4g,
③7.3gHCl,其物质的量为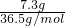 =0.2mol,
=0.2mol,
④0.2molCH4,质量为0.2mol×16g/mol=3.2g,
相同条件下,体积之比等于物质的量之比,故体积最大的是:①0.3mol氨气,
相同条件下,密度之比等于相对分子质量之比,CO2的相对分子质量最大,故密度最大的是:②CO2分子,
由上述计算可知,质量最大的是:③7.3gHCl,
故答案为:①;②;③;
(2)根据n= 可知,物质的量之比与摩尔质量成反比,故相同质量的SO2与SO3的物质的量之比为80g/mol:64g/mol=5:4,
可知,物质的量之比与摩尔质量成反比,故相同质量的SO2与SO3的物质的量之比为80g/mol:64g/mol=5:4,
相同质量SO2与SO3分子中含有的氧元素的质量之比为(5×2):(4×3)=5:6,
相同质量SO2与SO3分子中含有原子数目之比为(5×3):(4×4)=15:16.
故答案为:5:4;5:6;15:16.
分析:(1)根据N=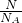 计算CO2分子的物质的量,根据n=
计算CO2分子的物质的量,根据n= 计算HCl的物质的量,根据m=nM计算氨气、二氧化碳、甲烷的质量,
计算HCl的物质的量,根据m=nM计算氨气、二氧化碳、甲烷的质量,
相同条件下,体积之比等于物质的量之比,据此判断体积大小;
相同条件下,密度之比等于相对分子质量之比,据此判断密度大小;
根据计算的氨气、二氧化碳、甲烷的质量,据此判断质量大小;
(2)根据n= 可知,相同质量的SO2与SO3,其物质的量之比与摩尔质量成反比,
可知,相同质量的SO2与SO3,其物质的量之比与摩尔质量成反比,
根据SO2与SO3分子中含有O原子数目,结合SO2与SO3的物质的量之比,利用m=nM计算判断氧元素的质量之比等于氧原子数目之比;
根据SO2与SO3分子中含有原子数目,结合SO2与SO3的物质的量之比,判断原子的物质的量之比.
点评:本题考查物质的量的有关计算、原子数目的计算等,比较基础,注意对公式的理解与灵活运用.
②6.02×1022个CO2分子,物质的量为
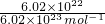 =0.1mol,质量为0.1mol×44g/mol=4.4g,
=0.1mol,质量为0.1mol×44g/mol=4.4g,③7.3gHCl,其物质的量为
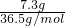 =0.2mol,
=0.2mol,④0.2molCH4,质量为0.2mol×16g/mol=3.2g,
相同条件下,体积之比等于物质的量之比,故体积最大的是:①0.3mol氨气,
相同条件下,密度之比等于相对分子质量之比,CO2的相对分子质量最大,故密度最大的是:②CO2分子,
由上述计算可知,质量最大的是:③7.3gHCl,
故答案为:①;②;③;
(2)根据n=
 可知,物质的量之比与摩尔质量成反比,故相同质量的SO2与SO3的物质的量之比为80g/mol:64g/mol=5:4,
可知,物质的量之比与摩尔质量成反比,故相同质量的SO2与SO3的物质的量之比为80g/mol:64g/mol=5:4,相同质量SO2与SO3分子中含有的氧元素的质量之比为(5×2):(4×3)=5:6,
相同质量SO2与SO3分子中含有原子数目之比为(5×3):(4×4)=15:16.
故答案为:5:4;5:6;15:16.
分析:(1)根据N=
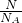 计算CO2分子的物质的量,根据n=
计算CO2分子的物质的量,根据n= 计算HCl的物质的量,根据m=nM计算氨气、二氧化碳、甲烷的质量,
计算HCl的物质的量,根据m=nM计算氨气、二氧化碳、甲烷的质量,相同条件下,体积之比等于物质的量之比,据此判断体积大小;
相同条件下,密度之比等于相对分子质量之比,据此判断密度大小;
根据计算的氨气、二氧化碳、甲烷的质量,据此判断质量大小;
(2)根据n=
 可知,相同质量的SO2与SO3,其物质的量之比与摩尔质量成反比,
可知,相同质量的SO2与SO3,其物质的量之比与摩尔质量成反比,根据SO2与SO3分子中含有O原子数目,结合SO2与SO3的物质的量之比,利用m=nM计算判断氧元素的质量之比等于氧原子数目之比;
根据SO2与SO3分子中含有原子数目,结合SO2与SO3的物质的量之比,判断原子的物质的量之比.
点评:本题考查物质的量的有关计算、原子数目的计算等,比较基础,注意对公式的理解与灵活运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
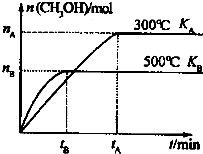 CO和H2与我们的生产和生活等方面密切相关.
CO和H2与我们的生产和生活等方面密切相关.