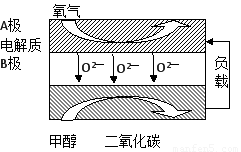
题目内容
在50℃时,向300g饱和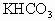 溶液中,逐滴加入密度为1.4g/
溶液中,逐滴加入密度为1.4g/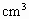 ,质量分数为63%的
,质量分数为63%的 溶解度为50g;
溶解度为50g; 在50℃溶解度为85g,10℃为20g.
在50℃溶解度为85g,10℃为20g.
求:
(1)恰好完全反应时,共滴入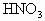 多少毫升?
多少毫升?
(2)50℃时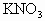 溶液的质量分数?
溶液的质量分数?
(3)10℃时析出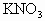 晶体多少克?
晶体多少克?
(4)要完全吸收所产生的气体生成正盐时,需要用10%的NaOH溶液多少克?
解析:
|
y=71.43(mL) 析出 n=43.6g |

在T℃时,向1 L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g)  aZ(g)+W(g) ΔH=-Q kJ/mol(Q>0);该反应达到平衡后,放出的热量为Q1
kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小。
aZ(g)+W(g) ΔH=-Q kJ/mol(Q>0);该反应达到平衡后,放出的热量为Q1
kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小。
请回答下列问题:
(1)化学计量数a的值为________。
(2)下列能说明该反应达到了化学平衡状态的是________(填序号)。
a.容器内压强一定
b.容器内气体的密度一定
c.容器内Z的分子数一定
d.容器内气体的质量一定
(3)维持T℃温度不变,若起始时向容器M中加入2 mol X、1 mol Y和1 mol Ar(稀有气体不参与反应),则反应达到平衡后放出的热量是________kJ。
(4)维持T℃温度不变,若在一个和原容器体积相等的恒压容器N中加入2 mol X和1 mol Y,发生题给反应并达到平衡,则________(填“M”或“N”)容器中的反应先达到平衡状态,容器中X的质量分数M________N(填“>”、“<”或“=”)。
(5)已知:该反应的平衡常数随温度的变化情况如表所示:
|
温度/℃ |
200 |
250 |
300 |
350 |
|
平衡常数K |
9.94 |
5.2 |
1 |
0.5 |
若在某温度下,2 mol X和1 mol Y在容器M中反应并达到平衡,X的平衡转化率为50%,则该温度为________℃。
(6)维持T℃温度不变,若起始时向容器M中加入4 mol X和6 mol Y,反应达到平衡时容器内的分子数目减少10%,则反应中放出的热量为________kJ。
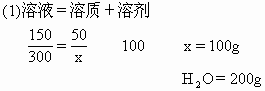
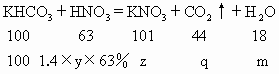
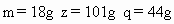
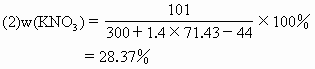
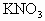 的质量=x-n=100-43.6=56.4g
的质量=x-n=100-43.6=56.4g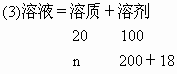
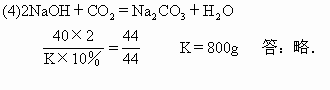
 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应: