��Ŀ����
���ܱ������У���1.0molCO��1.0molH2O��ϼ��ȵ�800�棬�������з�Ӧ��
CO(g)+H2O(g) CO2(g)+H2(g)��һ��ʱ���÷�Ӧ�ﵽƽ�⣬���CO�����ʵ���Ϊ0.5mol����
CO2(g)+H2(g)��һ��ʱ���÷�Ӧ�ﵽƽ�⣬���CO�����ʵ���Ϊ0.5mol����
(1)�ﵽƽ��ʱCO2�����ʵ��������÷�Ӧ�Ļ�ѧƽ�ⳣ����
(2)�ﵽƽ������ƽ����ϵ��ͨ��1.0molˮ�������ﵽ�µ�ƽ��״̬ʱ����ˮ���������ʵ�����CO2�����ʵ���������
(1)25% 1
(2)1.33mol 22.22%
������������� CO(g) + H2O(g)  CO2(g) + H2(g)
CO2(g) + H2(g)
��ʼ���ʵ����� 1.0mol 1.0mol 0 0
ת���� x x x x
ƽ�����ʵ����� (1-x)mol (1-x)mol x x
�������֪�� x=0.5mol
�ﵽƽ��ʱCO2�����ʵ�������Ϊ��x/2=0.25=25%
�÷�Ӧ�Ļ�ѧƽ�ⳣ��: 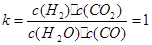
�� CO(g) + H2O(g)  CO2(g) + H2(g)
CO2(g) + H2(g)
ƽ��ʱ�����ʵ�Ũ�ȣ� 0.5mol 0.5mol 0.5mol 0.5mol
ͨ��1.0molˮ������ 0.5mol 1.5mol 0.5mol 0.5mol
ת���� y y y y
�ٴ�ƽ�⣺ ��0.5-y�� (1.5-y) (0.5+y) (0.5+y)
����ƽ�ⳣ���У�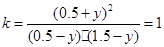
��֮�ã�
ˮ���������ʵ���:n(H2O)=1.5-0.5/3=4/3mol
CO2�����ʵ�������: 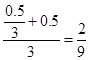
���㣺ƽ�ⳣ�����й�֪ʶ��

 ��һ����ͬ���ɽ�����ϵ�д�
��һ����ͬ���ɽ�����ϵ�д� ������Ӧ���ϵ�д�
������Ӧ���ϵ�д� ��ʦ�㾦�ִʾ��ƪϵ�д�
��ʦ�㾦�ִʾ��ƪϵ�д���13�֣���Щ�������������Ƶ�����ּ���������������̼�������������������ǵ��¼�����������Ҫ���أ��о���Щ��������ۺϴ���������Ҫ���塣
��1����ҵ�Ͽ����ö�����̼�Ͱ����ϳ����أ����ܷ�Ӧ���£�
2NH3(g)+CO2(g)  CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l) 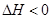 ���÷�Ӧ�� ����ϸ��¶ȡ��ϵ��¶ȡ��������Է����С�
���÷�Ӧ�� ����ϸ��¶ȡ��ϵ��¶ȡ��������Է����С�
��2����֪�ϳ����ط��������У�
��1����2NH3(g)+CO2(g) NH2COONH4(s)
NH2COONH4(s) 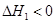
��2����NH2COONH4(s) CO(NH2)2(l)+ H2O(l)
CO(NH2)2(l)+ H2O(l) 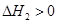
����ʾ��ͼ��[a��ʾ2NH3(g)+ CO2(g)��b��ʾNH2COONH4(S)��c��ʾCO(NH2)2(l)+ H2O(l)]������ȷ��ʾ���غϳɹ����������仯���ߵ��ǣ�����ţ� ��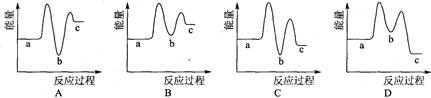
��3���ϳ����ع����У���NH3��CO2�����ʵ���֮��Ϊ1:2ʱ��NH3
��ת������ʱ��ı仯��ϵ��ͼ��ʾ��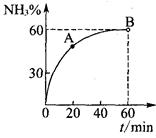
��A����淴Ӧ����v��(CO2) B����淴Ӧ����
v�� (CO2)(�������������=��)��
�ڴﵽƽ��ʱ��CO2��ת����Ϊ ��
��4������̿�����ڴ���������Ⱦ��NO����ij1L�����ܱ������м��� 0.100molNO ��2.030mol�������̿�������ʣ�����������E������F�����¶ȷֱ���T1���T2��ʱ�����ƽ��ʱ�����ʵ����ʵ������±���
 ���� ����n/mol T/�� | ����̿ | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
��������Ӧ��T1��ʱ��ƽ�ⳣ��ΪK1����T2��ʱ��ƽ�ⳣ��ΪK2������K1= �����������Ϣ�жϣ�T1��T2�Ĺ�ϵ�� ��
A. T1>T2 B. T1<T2 C.���Ƚ�
�����ܱ�����Ϊ�ݻ��ɱ䣬���ݻ�ѧ��Ӧԭ������������ѹǿ�Ը÷�Ӧ��Ӱ��
��
������N2H4��������������һ����Ҫ�Ļ��ȼ�ϡ�N2H4��N2O4��Ӧ�ܷų��������ȡ�
��1����֪��2NO2��g�� N2O4��g�� ��H=-57.20kJ��mol-1��һ���¶��£����ܱ������д˷�Ӧ�ﵽƽ�⡣ ������������ʱ�����д�ʩ����ʹNO2ת������ߵ���
N2O4��g�� ��H=-57.20kJ��mol-1��һ���¶��£����ܱ������д˷�Ӧ�ﵽƽ�⡣ ������������ʱ�����д�ʩ����ʹNO2ת������ߵ���
| A������NO2��Ũ�� | B�������¶� | C������NO2��Ũ�� | D�������¶� |
��3��17�桢1.01��105Pa���ܱ�������N2O4��NO2�Ļ������ﵽƽ��ʱ��c��NO2��="0.0300" mol��L-1��c��N2O4��="0.0120" mol��L-1�����㷴Ӧ2NO2��g��
 N2O4��g����ƽ�ⳣ��K= ��
N2O4��g����ƽ�ⳣ��K= ����4����������ˮ�������백���Ƶ�����õ��뷽��ʽ��ʾ�µ�ˮ��Һ�Լ��Ե�ԭ�� ��
��5����֪����ͬ������N2H4?H2O�ĵ���̶ȴ���N2H5C1��ˮ��̶ȡ������£�����0.2mol/L N2H4?H2O��Һ��0.1mol/L HCl��Һ�������ϣ�����Һ��N2H5+��Cl-��OH-��H+����Ũ���ɴ�С��˳��Ϊ��__________��
��6����-����ȼ�ϵ����һ�ּ���ȼ�ϵ�أ��������Һ��20%��30%��KOH��Һ����-����ȼ�ϵ�طŵ�ʱ�������ĵ缫��Ӧʽ�� ����ع���һ��ʱ��������Һ��pH�� �����������С���������䡱����
��ҵ������ʱ�����ô�������Ӧ��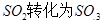 ��һ���ؼ��IJ��衣
��һ���ؼ��IJ��衣
��1��ij�¶��£�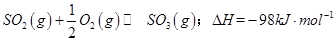 ����ʼʱ��100L���ܱ������м���4.0molSO2(g)��10.0molO2������Ӧ�ﵽƽ��ʱ���ų�����196kJ�����¶���ƽ�ⳣ��K=____________��
����ʼʱ��100L���ܱ������м���4.0molSO2(g)��10.0molO2������Ӧ�ﵽƽ��ʱ���ų�����196kJ�����¶���ƽ�ⳣ��K=____________��
��2��һ�������£���һ���������ܱ������г���2mol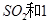 mol
mol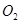 ,������Ӧ:
,������Ӧ: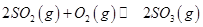 ,��ƽ���ı�����������
,��ƽ���ı����������� ����ƽ��Ũ�ȶ���ԭ���������____________(����ĸ)��
����ƽ��Ũ�ȶ���ԭ���������____________(����ĸ)��
A�������¶Ⱥ�����������䣬����2mol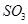 |
| B�������¶Ⱥ�����������䣬����2molN2 |
C�������¶Ⱥ�������ѹǿ���䣬����1mol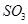 |
| D���ƶ�����ѹ������ |
��3�������
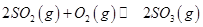 ��Ӧ��ͼ���У�����ȷ����_________��
��Ӧ��ͼ���У�����ȷ����_________��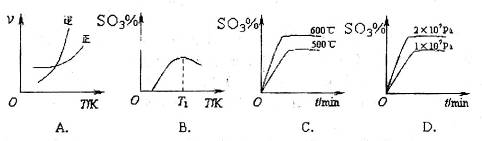
��4��ͬѧ��ѧϰ�˵绯ѧ֪ʶ��������������õ��ķ������������ᣬ�ɱ���������꣬��Ⱦ���������Ǵ�������һ���Բ�Ϊ�缫�������ֱ�ͨ��SO2�Ϳ��������Ե��Һ��ʵ�ֵ���������ᡣ
�������ĵ缫��ӦΪ______________________________��
�������ҺΪ2L0.025mol
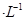 ��������Һ���������̹�ת����0.1mol����ʱ������������SO2�����Ϊ����״����Ϊ_________������Һ��pH="__________" (������Һ����仯)��
��������Һ���������̹�ת����0.1mol����ʱ������������SO2�����Ϊ����״����Ϊ_________������Һ��pH="__________" (������Һ����仯)�� ����ƴ�ʵ����뷨�õ�����ʦ�ij�ֿ϶������빤ҵ������������Ȼ����кܶ�㣬��Դ�ʵ����к���������____________________________��д��һ�㼴�ɣ���
���������(Na2S2O3)�׳ƴ��մ�����ҵ��������Ӱ����Na2S2O3������ˮ����������Һ�����ᷴӦ�е������SO2���ɡ�
��1��Na2S2O3��Һ��ϡ�����Ϸ�Ӧ������̽����������Է�Ӧ���ʵ�Ӱ�죬����йص�ʵ����Ʊ�(��֪����Һ�����Ϊ5 mL)��
| ʵ���� | T/K | c(Na2S2O3)/ mol��L��1 | c(H2SO4)/ mol��L��1 | ʵ��Ŀ�� |
| �� | 298 | 0.1 | 0.1 | ʵ��ٺ͢�̽���¶ȶԸ÷�Ӧ���ʵ�Ӱ�죻ʵ��١��ۺ͢�̽����Ӧ��Ũ�ȶԸ÷�Ӧ���ʵ�Ӱ�� |
| �� | 308 | | | |
| �� | | 0.2 | | |
| �� | | 0.1 | |
��2��Na2S2O3�����к�ǿ�Ļ�ԭ�ԣ�Na2S2O3��Һ��������ˮ��Ӧ�Ļ�ѧ����ʽΪ��
________ (��ʾ��SԪ�ر�����ΪSO)��
��3������һƿNa2S2O3���壬���ܺ���Na2SO4���壬�����ʵ����֤��д��ʵ�鲽�衢Ԥ������ͽ��ۡ���ѡ�Լ��� 1 mol��L��1 H2SO4��1 mol��L��1 HNO3��1 mol��L��1 HCl��1 mol��L��1 NaOH��0.1 mol��L��1 BaCl2��0.01 mol��L��1 KMnO4������ˮ��
| ʵ�鲽�� | Ԥ������ͽ��� |
| ����1��ȡ�����������Թ��У�������ˮ�ܽ� | |
| ����2�� | |
| ����3�� | |
 2 NH3
2 NH3 2Z(��)��ѹǿһ��ʱ�������ƽ��ʱZ���������Ϊ0.4��
2Z(��)��ѹǿһ��ʱ�������ƽ��ʱZ���������Ϊ0.4��
 2SO3(g) ���÷�Ӧ��ƽ�ⳣ������ʽΪK= ��������SO2��NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ
2SO3(g) ���÷�Ӧ��ƽ�ⳣ������ʽΪK= ��������SO2��NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ