题目内容
2.有些化学反应不论反应物量的多少,都只能用同一个离子方程式来表示.下列各组在溶液中的反应符合这一情况的是( )| A. | Na2SiO3与SO2 | B. | Al2(SO4)3和 氨水 | C. | FeI2与Cl2 | D. | NaHCO3与Ca(OH)2 |
分析 A.二氧化硫过量时生成亚硫酸氢钠,二氧化硫不足时生成亚硫酸钠;
B.硫酸铝与氨水反应生成氢氧化铝沉淀和一水合氨,与反应物量的多少无关;
C.氯气足量时,亚铁离子和溴离子都被氧化,氯气不足时,只有亚铁离子被氧化;
D.氢氧化钙足量时,反应生成碳酸钙沉淀、氢氧化钠和水,氢氧化钙不足时,反应生成碳酸钠、碳酸钙沉淀和水.
解答 解:A.二氧化硫不足时的反应为:SiO32-+SO2+H2O=H2SiO3↓+SO32-,二氧化硫过量时的反应为:SiO32-+2SO2+2H2O=H2SiO3↓+2HSO3-,反应物的量不同,离子方程式不同,故A错误;
B.硫酸铝与氨水反应的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,与反应物量的多少无关,故B正确;
C.氯气少量,只有亚铁离子被氧化,而氯气足量,亚铁离子、碘离子均被氧化,产物不同,不能用同一个离子方程式来表示,故C错误;
D.NaHCO3少量时,发生反应为:NaHCO3+Ca(OH)2═CaCO3↓+H2O+NaOH,NaHCO3过量时发生反应:2NaHCO3+Ca(OH)2═CaCO3↓+2H2O+Na2CO3,则不能用同一离子方程式表示,故D错误;
故选B.
点评 本题考查与量有关的离子反应,题目难度中等,明确反应的产物是解答的关键,侧重氧化的先后与反应的先后顺序的考查,试题有利于提高学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列各组物质中所含原子数相同的是( )
| A. | 10gH2 和10gO2 | B. | 5.6LN2(标准状况)和11gCO2 | ||
| C. | 9gH2O和0.75molBr2 | D. | 224mL H2(标准状况)和0.1molN2 |
13.在常温下,纯水中存在电离平衡H2O?H++OH-,如果要使水的电离程度增大,并使c(H+)增大,应加入的物质是( )
| A. | NaHSO4 | B. | KAl(SO4)2 | C. | NaHCO3 | D. | CH3COONa |
10.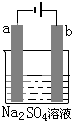 图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )
图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )
 图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )
图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )| A. | a电极的产物有Cu和H2 | |
| B. | 反应一段时间后,溶液的pH值变小 | |
| C. | a电极附近呈红色,b电极附近出现蓝色. | |
| D. | a、b电极转移的电子数为0.4mol |
7.化学在工农业生产和日常生活中都有着重要的应用.下列叙述不正确的是( )
| A. | 长期使用(NH4)2SO4化肥会使土壤酸化,而过度使用尿素[CO(NH2)2]会使土壤碱化 | |
| B. | 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 | |
| C. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 | |
| D. | 神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是SiO2 |
14.某外控型食品保鲜剂以淀粉、二氧化硅(SiO2)为载体,吸附酒精制作而成.保鲜原理是酒精缓慢挥发,在食品周围形成一定浓度的气体保护层.下列说法不正确的是( )
| A. | SiO2中的Si的化合价为+4 | B. | 起保鲜作用的物质是酒精 | ||
| C. | 该保鲜剂不能与明火接触 | D. | 酒精挥发时分子体积变大 |
12.氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用.
(1)根据下面能量变化示意图(图1),请写出 NO 和 CO2 反应的热化学方程式NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1.

(2)在固定体积的密闭容器中,进行如下化学反应:2NH3(g)?N2(g)+3H2(g)△H>0,其平衡常数 K 与温度 T 的关系如表:
①试判断 K1<K2(填写“>”,“<”或“=”);
②该反应的熵变△S>0 (填“>”,“<”或“=”);
③下列各项能说明该反应已达到平衡状态的是c(填字母);
a.容器内 N2、H2、NH3 的物质的量之比为 1:3:2
b.2v(NH3)正=3v(H2)
c.容器内混合气体平均相对分子质量保持不变
d.混合气体的密度保持不变
④一定温度下,在 1L 密闭容器中充入 1molN2 和 3molH2 并发生反应.若容器容积恒 定,10min 达到平衡时,气体的总物质的量为原来的$\frac{9}{10}$,则 N2 的转化率 α(N2)=20%.
(3)在常温常压下 pH 均等于 5 的 CH3COOH 和 HCl 溶液,两种溶液中由水电离出来的c(H+)之比为1:1.
(4)对反应 N2O4(g)?2NO2(g)△H>0,在温度分别为 T1、T2时,平衡体 系中 NO2 的体积分数随压强变化曲线如图2所示,下列说法正确的是cd.
a.A、C 两点的反应速率:A>C
b.A、C 两点的化学平衡常数:A>C
c.A、C 两点 N2O4 的转化率:A>C
d.由状态 B 到状态 A,可以用加热的方法.
(1)根据下面能量变化示意图(图1),请写出 NO 和 CO2 反应的热化学方程式NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1.

(2)在固定体积的密闭容器中,进行如下化学反应:2NH3(g)?N2(g)+3H2(g)△H>0,其平衡常数 K 与温度 T 的关系如表:
| T/K | 2.98 | 398 | 498 |
| 平衡常数K | 2.44×10-6 | K1 | K2 |
②该反应的熵变△S>0 (填“>”,“<”或“=”);
③下列各项能说明该反应已达到平衡状态的是c(填字母);
a.容器内 N2、H2、NH3 的物质的量之比为 1:3:2
b.2v(NH3)正=3v(H2)
c.容器内混合气体平均相对分子质量保持不变
d.混合气体的密度保持不变
④一定温度下,在 1L 密闭容器中充入 1molN2 和 3molH2 并发生反应.若容器容积恒 定,10min 达到平衡时,气体的总物质的量为原来的$\frac{9}{10}$,则 N2 的转化率 α(N2)=20%.
(3)在常温常压下 pH 均等于 5 的 CH3COOH 和 HCl 溶液,两种溶液中由水电离出来的c(H+)之比为1:1.
(4)对反应 N2O4(g)?2NO2(g)△H>0,在温度分别为 T1、T2时,平衡体 系中 NO2 的体积分数随压强变化曲线如图2所示,下列说法正确的是cd.
a.A、C 两点的反应速率:A>C
b.A、C 两点的化学平衡常数:A>C
c.A、C 两点 N2O4 的转化率:A>C
d.由状态 B 到状态 A,可以用加热的方法.