题目内容
【题目】将1molCH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,且产物均为气体(101kPa,120℃),其总质量为72g,下列有关叙述不正确的是( )
A.若将产物通过碱石灰,则可全被吸收,若通过浓硫酸,则不能被完全吸收
B.产物的平均摩尔质量为24g/mol
C.若将产物通过浓硫酸充分吸收后恢复至(101kPa,120℃),则体积变为原来的![]()
D.反应中消耗的氧气为1.75mol
【答案】A
【解析】
1molCH4质量为16g,在适量的氧气中点燃,产物均为气体(101kPa,120℃),其总质量为72g,则依据质量守恒定律,参加反应的O2质量为72g-16g=56g,物质的量为![]() =1.75mol,由此得出反应的化学方程式为4CH4+7O2
=1.75mol,由此得出反应的化学方程式为4CH4+7O2![]() 2CO+2CO2+8H2O(g)。
2CO+2CO2+8H2O(g)。
A.若将产物通过碱石灰,能吸收CO2和水蒸气,但CO不能被吸收,A不正确;
B.由反应知,若有4molCH4参加反应,产物为12mol,则1molCH4参加反应,产物应为3mol,所以产物的平均摩尔质量为![]() =24g/mol,B正确;
=24g/mol,B正确;
C.依据反应方程式,若将产物通过浓硫酸充分吸收后恢复至(101kPa,120℃),气体由12mol变为4mol,则体积变为原来的![]() ,C正确;
,C正确;
D.从上面的计算可知,1molCH4参加反应,产物总质量为72g,反应中消耗的氧气为1.75mol,D正确;
故选A。

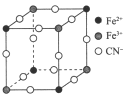
【题目】下表为元素周期表的一部分,表中序号分别代表某一元素。请回答下列问题。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ⑨ | |||||
3 | ① | ③ | ④ | ⑤ | ⑧ | |||
4 | ② |
(1)①~⑨中,最活泼的金属元素是________,最不活泼的元素是______。(写元素符号)。
(2)⑦和⑧的气态氢化物,更稳定的是_____(写电子式)。
(3)原子半径:①_____⑥(填“>
(4)①~⑧的最高价氧化物对应的水化物中:酸性最强的是_____(填化学式,下同);碱性最强的是_______,具有两性的是_______。
(5)①的最高价氧化物对应的水化物与⑧的气态氢化物水溶液发生反应,其离子方程式是___。
【题目】下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
B |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性.Cl2>Br2>I2 |
C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
D | 浓HNO3加热 | 有红棕色气体 | HNO3有强氧化性 |
A. A B. B C. C D. D
【题目】下列有关实验现象和解释或结论都正确的是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | 取硫酸催化淀粉水解的反应液,滴入少量新制 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
B |
| 有白色絮状沉淀生成 | 二者水解相互促进生成氢氧化铝沉淀 |
C | 将充满 | 红棕色变深 | 反应 |
D | 向 | 得到红褐色透明液体 | 得到 |
A.AB.BC.CD.D
【题目】已知常温下碳酸、亚硫酸、次氯酸的电离平衡常数如下表:
H2CO3 | H2SO3 | HClO |
K1=4.30×10-7 | K1=1.54×10-2 | K=2.95×10-8 |
K2=5.61×10-11 | K2=1.02×10-7 |
下列说法正确的是
A. 相同条件下,同浓度的 H2SO3溶液和 H2CO3溶液的酸性, 后者更强
B. Na2CO3溶液中通入少量SO2: 2CO3 2- + SO2+ H2O = 2HCO3 - + SO3 2-
C. NaClO 溶液中通入少量CO2:2ClO- + CO2 + H2O = 2HClO + CO3 2-
D. 向氯水中分别加入等浓度的 NaHCO3 和 NaHSO3溶液,均可提高氯水中 HClO 的浓度