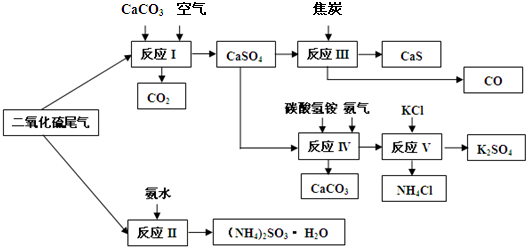
题目内容
在合成硫酸的生产中,采用了“接触法制硫酸”,反应过程中使SO2与O2在V2O5催化剂表面进行接触而转化为SO3。即2SO2+O2(1)在生产中,实际上使用过量的空气,其目的是___________________。
(2)该反应的正反应为放热反应,但实际生产时须加热至500 ℃左右,其理由_________。
(3)实际生产中应采用常压还是高压?__________________,其理由是________________。
解析:本题需迁移所学勒夏特列原理综合考虑,合理选择SO2转化为SO3的适宜条件。
本题可以从以下几点进行分析:
(1)当增大某一反应物浓度时,会导致化学平衡向正反应方向移动,从而提高另一种反应物的转化率;
(2)工业生产或化学实验中,常常需要加热,对放热反应也不例外,这个问题应从温度与反应速率的关系,以及催化剂的活性温度两个方面去综合考虑;
(3)压强应从生产的实际需要,对平衡移动的影响,反应物的转化率,以及生产设备承压能力、动力系统的要求等多方面去综合考虑。
答案:(1)因为反应为2SO2+O2![]() 2SO3,所以增大O2的浓度,导致平衡正向移动,使成本较高的原料气SO2得到充分利用,提高了SO2的转化率
2SO3,所以增大O2的浓度,导致平衡正向移动,使成本较高的原料气SO2得到充分利用,提高了SO2的转化率
(2)因为反应为2SO2+O2![]() 2SO3;ΔH<0,正反应为放热反应,虽然低温有利于反应正向进行,但反应速率太慢。因而从提高反应速率的要求应使反应在加热的条件下进行,同时V2O5催化剂的活性温度为500 ℃左右。在500 ℃?左右既可以加快反应速率,缩短达到平衡所需要的时间,又可以使催化剂得以发挥最大作用
2SO3;ΔH<0,正反应为放热反应,虽然低温有利于反应正向进行,但反应速率太慢。因而从提高反应速率的要求应使反应在加热的条件下进行,同时V2O5催化剂的活性温度为500 ℃左右。在500 ℃?左右既可以加快反应速率,缩短达到平衡所需要的时间,又可以使催化剂得以发挥最大作用
(3)常压 因为φ(SO3)=91%,所以选择常压生产即有较大的转化率了,不必要采用高压,高压对生产设备、动力系统、生产安全等方面要求高、难度大,成本高,因而不适宜

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目