题目内容
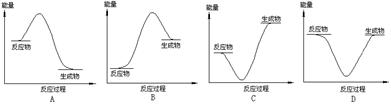
单斜硫和正交硫转化为二氧化硫的能量变化图如图所示。
下列说法正确的是
| A.S(s,单斜)=S(s,正交) ΔH=+0.33 kJ·mol-1 |
| B.正交硫比单斜硫稳定 |
| C.相同物质的量的正交硫比单斜硫所含有的能量高 |
| D.①式表示断裂1 mol O2中的共价键所吸收的能量比形成1 mol SO2中的共价键所放出的能量少297.16 kJ |
B
解析

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目
已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是
| A.X的能量一定低于M的,Y的能量一定低于N的 |
| B.因为该反应为吸热反应,故一定要加热反应才能进行 |
| C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 |
| D.X和Y的总能量一定低于M和N的总能量 |
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 (填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断,ΔH1 0(填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
已知:①H2(g)+ O2(g)=H2O(g)
O2(g)=H2O(g)  kJ·mol-1,② C(s)+
kJ·mol-1,② C(s)+ O2(g)="CO(g)"
O2(g)="CO(g)"  kJ·mol-1。由此可知焦炭与水蒸气反应的热化学方程式为:C(s)+H2O(g)=CO(g)+H2(g)
kJ·mol-1。由此可知焦炭与水蒸气反应的热化学方程式为:C(s)+H2O(g)=CO(g)+H2(g)  ,则
,则 为
为
| A.+131.3 kJ·mol-1 | B.-131.3 kJ·mol-1 |
| C.+352.3 kJ·mol-1 | D.-352.3 kJ·mol-1 |
下列有关说法正确的是
| A.放热反应在任何条件都能自发进行 |
| B.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液 |
| D.电解精炼铜时,外电路中转移电子数为2NA个时,阳极铜质量减少64g |
反应A(g)+B(g)—→C(g) ΔH,分两步进行:①A(g)+B(g)—→X(g) ΔH1;②X(g)—→C(g) ΔH2。反应过程中能量变化如图所示,E1表示A+B—→X的活化能,下列说法正确的是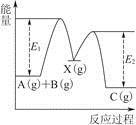
| A.ΔH1=ΔH-ΔH2>0 |
| B.X是反应A(g)+B(g)—→C(g)的催化剂 |
| C.E2是反应②的活化能 |
| D.ΔH=E1-E2 |
下列关于反应能量的说法正确的是( )
| A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)ΔH=-216 kJ/mol,则反应物总能量大于生成物总能量 |
| B.若一定条件下,A=B ΔH<0,说明A物质比B物质稳定 |
| C.101 kPa时,2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ/mol,则H2的燃烧热为571.6 kJ/mol |
| D.H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ/mol,含1 mol NaOH的溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 |
已知热化学方程式:SO2(g)+O2(g) SO3(g) ΔH="-98.32" kJ·mol-1,在容器中充入2 mol SO2和1 mol O2,充分反应,最终放出的热量( )
SO3(g) ΔH="-98.32" kJ·mol-1,在容器中充入2 mol SO2和1 mol O2,充分反应,最终放出的热量( )
| A.="196.64" kJ | B.="98.32" kJ |
| C.<196.64 kJ | D.>196.64 kJ |