题目内容
8.下列反应中,浓硫酸既表现强酸性,又表现强氧化性的是( )| A. | 烧红的木炭和热的浓硫酸 | B. | 铜和浓硫酸共热 | ||
| C. | 食盐和浓硫酸共热 | D. | 蔗糖中滴入浓硫酸 |
分析 在反应中浓硫酸体现酸性,说明和物质反应生成硫酸盐,又体现强氧化性,说明在反应中S元素得电子化合价降低,据此分析解答.
解答 解:A.发生的反应为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,该反应硫酸中S元素化合价由+6价变为+4价,所以浓硫酸作氧化剂,体现氧化性,故A不选;
B.发生的反应为Cu+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,该反应中部分S元素化合价不变、部分S元素化合价由+6价变为+4价,所以浓硫酸体现酸性、强氧化性,故B选;
C.发生的反应为 2NaCl+H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$2HCl↑+Na2SO4,该反应中各元素化合价不变,属于复分解反应,浓硫酸体现酸性,故C不选;
D.浓硫酸将有机物中的H、O元素以2:1水的形式脱去而体现脱水性,还能将C氧化为二氧化碳而强氧化性,故D不选;
故选B.
点评 本题考查浓硫酸的性质,浓硫酸具有吸水性、脱水性、强氧化性和酸性,知道吸水性和脱水性区别,注意C反应原理是利用高沸点酸制取易挥发性酸,题目难度不大.

练习册系列答案
相关题目
3.在标准状况下将1.92g铜粉投入一定量浓HNO3中随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由NO2和NO组成的混和气体1.12L,则混和气体中NO的体积为( )
| A. | 112mL | B. | 1008mL | C. | 224mL | D. | 448mL |
13.属于氮的固定的是( )
| A. | 植物从土壤中吸收含氮养料 | |
| B. | 豆科植物把含氮化合物转变为蛋白质 | |
| C. | 将空气中的氮气转化为含氮化合物 | |
| D. | NH3经催化氧化生成NO |
20.下列对碱金属的叙述,其中完全不正确的组合是:( )
①K通常保存在煤油中,以隔绝与空气的接触
②从Li到Cs,碱金属与水反应越来越不剧烈
③钠的焰色反应呈黄色,焰色反应是化学变化
④碱金属阳离子,氧化性最强的是Li+
⑤碱金属的原子半径和离子半径都随核电荷数的增大而增大
⑥从Li到Cs,碱金属的密度越来越大,熔、沸点越来越高
⑦CsOH是强碱,碱性比KOH强
⑧Cs2CO3加热时易分解成CO2和Cs2O.
①K通常保存在煤油中,以隔绝与空气的接触
②从Li到Cs,碱金属与水反应越来越不剧烈
③钠的焰色反应呈黄色,焰色反应是化学变化
④碱金属阳离子,氧化性最强的是Li+
⑤碱金属的原子半径和离子半径都随核电荷数的增大而增大
⑥从Li到Cs,碱金属的密度越来越大,熔、沸点越来越高
⑦CsOH是强碱,碱性比KOH强
⑧Cs2CO3加热时易分解成CO2和Cs2O.
| A. | ②③⑥⑧ | B. | ②③④⑦ | C. | ④⑤⑥⑧ | D. | ①④⑤⑦ |
17.设NA为阿伏加德罗常数的值.下列有关物质结构的说法正确的是( )
| A. | 78gNa2O2晶体中所含阴、阳离子个数均为2NA | |
| B. | PCl3和H2O分子中所有原子的最外层都达到8电子稳定结构 | |
| C. | 1.8gD2O含有NA个中子 | |
| D. | 3.4g氨气中含有0.6NA个N-H键 |
9.硅孔雀石是一种含铜矿石,含铜形态为CuCO3•Cu(OH)2和CuSiO3•2H2O,
同时含有SiO2、FeCO3、Fe2O3、A12O3等杂质.以其为原料制取硫酸铜的工艺
流程如下图所示:
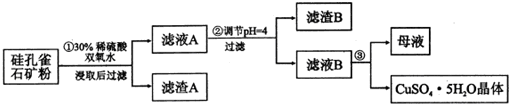
(1)步骤1中先加入足量稀硫酸,再加入双氧水,则双氧水参与该反应的离子方程式是2Fe2++H2O2+2H+═2Fe3++2H2O
(2)步骤②调节溶液pH,可以选用的试剂是BC.(填字母编号)
A.Al2O3B.CuOC.CuCO3•Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
则滤液B中含有的阳离子是Al3+、Cu2+、H+.
(4)将滤液B通过蒸发浓缩、冷却结晶、过滤等操作可得到硫酸铜晶体.
(5)硫酸铜也可用硫化铜和氧气在高温、催化剂条件下化合制得,该反应的化学方程式是:
取384gCuS在一定条件下和氧气完全反应,或发生:2CuS+3O2=2CuO+2SO2和
4CuS+5O2=2Cu2O+4SO2;两个反应,在所得固体中Cu和O的物质的量之比n(Cu):n(O)=4:a,此时消耗空气的物质的量为b mol,则a=a=$\frac{2}{5}$b-8.(氧气占空气体积的1/5)
同时含有SiO2、FeCO3、Fe2O3、A12O3等杂质.以其为原料制取硫酸铜的工艺
流程如下图所示:

(1)步骤1中先加入足量稀硫酸,再加入双氧水,则双氧水参与该反应的离子方程式是2Fe2++H2O2+2H+═2Fe3++2H2O
(2)步骤②调节溶液pH,可以选用的试剂是BC.(填字母编号)
A.Al2O3B.CuOC.CuCO3•Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(4)将滤液B通过蒸发浓缩、冷却结晶、过滤等操作可得到硫酸铜晶体.
(5)硫酸铜也可用硫化铜和氧气在高温、催化剂条件下化合制得,该反应的化学方程式是:
取384gCuS在一定条件下和氧气完全反应,或发生:2CuS+3O2=2CuO+2SO2和
4CuS+5O2=2Cu2O+4SO2;两个反应,在所得固体中Cu和O的物质的量之比n(Cu):n(O)=4:a,此时消耗空气的物质的量为b mol,则a=a=$\frac{2}{5}$b-8.(氧气占空气体积的1/5)
 ②C(CH3)4的系统命名:2,2-二甲基丙烷.
②C(CH3)4的系统命名:2,2-二甲基丙烷.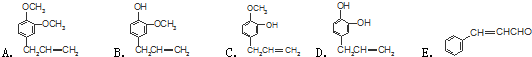
 $\stackrel{反应②}{→}$X,
$\stackrel{反应②}{→}$X, .
. 甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.
甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.