题目内容
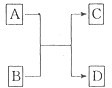
A、B、C、X均属中学化学中常见的物质,且X为单质。其中副产物已被略去,例如水等。回答下列问题:![]()
(1)若X具有强氧化性,举两例分别写出对应的A、B、C的化学式(FeS2不能填写)。
例1:A________________,B________________,C________________。 例2:A_____________, B______________,C______________。
(2)若X为较活泼的金属,向C的水溶液中滴加硝酸银溶液有不溶于稀硝酸的白色沉淀析出,则B可能的化学式是_______________。若将铜片和碳棒用导线连接后插入B的水溶液中,构成原电池,写出负极的电极反应式:__________________________________________。
(3)若上述(2)中C溶液保存时需加入少量X,理由是____________________________。
(4)若A是一种常见的无机化合物,请写出反应①的化学方程式:(只要求写一例)
____________________________________________________________________。
(5)某工厂用含FeS260%的硫铁矿通过上述途径制取硫酸。已知反应①中S的损失率为2%,反应②中S的转化率为90%,则100 t硫铁矿可生产98%的浓硫酸__________吨。
(1)A:S B:SO
A:C B:CO C:CO2
(其他答案均可)
(2)FeCl3 Cu-2e-====Cu2+
(3)防止Fe2+被氧化
(4)4NH3+5O2![]() 4NO+6H2O(其他合理答案均可)
4NO+6H2O(其他合理答案均可)
(5)88.2
解析:(1)问,X具有强氧化性,可知A能被X连续氧化,若A为单质,则A对应元素至少有2个正价,这样的元素有S和C、N等。(2)问,C溶液中滴加AgNO3溶液有不溶于稀HNO3的白色沉淀析出,说明C含Cl-。若C中Cl-由B中氯元素还原生成,B中氯元素为0价、+1价、+3价、+5价、+7价均不合理,说明B为氯化物,B→C的氧化还原发生在金属元素X的不同价态之间,则X属于有多个价态的变价金属元素,据此进一步试探,X为Fe,A为Cl2,B为FeCl3,C为FeCl2时合理。C、Cu、FeCl3构成的原电池中,Cu作负极,负极电极反应式为Cu-2e-![]() Cu2+。(3)问,FeCl2溶液中加入少量Fe的目的是防止Fe2+被氧化。(4)问,A是常见无机化合物时,其能与物质X连续发生反应,A可为NH3与O2反应,还可为Ba(OH)2与CO2反应,等等。(5)问,设可得98%的浓H2SO4的质量为x。
Cu2+。(3)问,FeCl2溶液中加入少量Fe的目的是防止Fe2+被氧化。(4)问,A是常见无机化合物时,其能与物质X连续发生反应,A可为NH3与O2反应,还可为Ba(OH)2与CO2反应,等等。(5)问,设可得98%的浓H2SO4的质量为x。
FeS2—2SO2—2SO3—2H2SO4
120 t 2×98t
100 t×60%×(1-2%)×90% x·98%
x=![]() =88.2 t
=88.2 t

 (2013?江西模拟)(一)X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的二种元素,M是地壳中含量最高的金属元素.回答下列问题:
(2013?江西模拟)(一)X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的二种元素,M是地壳中含量最高的金属元素.回答下列问题: →
→