题目内容
10.向一定体积0.1mol/L醋酸溶液中加入等体积的蒸馏水后,则下列叙述正确的是( )| A. | 溶液的pH值变小 | |
| B. | 醋酸的电离程度降低 | |
| C. | 溶液的导电能力减弱 | |
| D. | 中和此溶液所需的0.1mol/LNaOH溶液的体积增加 |
分析 A.加水稀释促进醋酸电离,但溶液中氢离子浓度减小,溶液的pH增大;
B.加水稀释促进醋酸电离;
C.溶液的导电能力与离子浓度成正比;
D.中和酸需要碱的量只与酸的物质的量有关与酸的浓度无关.
解答 解:A.加水稀释促进醋酸电离,但醋酸增大的电离程度小于溶液体积增大程度,所以氢离子浓度减小,溶液的pH增大,故A错误;
B.加水稀释促进醋酸电离,则醋酸的电离程度增大,故B错误;
C.溶液的导电能力与离子浓度有关,加水稀释促进醋酸电离但溶液中离子浓度减小,所以溶液的导电能力减弱,故C正确;
D.中和酸需要碱的量只与酸的物质的量有关与酸的浓度无关,所以中和此溶液所需的0.1mol•L-1 NaOH溶液的体积不变,故D错误;
故选C.
点评 本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,知道碱中和酸只与酸的物质的量有关,与酸的强弱、浓度无关,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列反应的离子方程式书写正确的是( )
| A. | Fe(NO3)3溶液加入足量HI溶液:2Fe3++2I-=2Fe2++I2 | |
| B. | 用H2O2和H2SO4的混合溶液刻蚀铜:Cu+H2O2+2H+=Cu2++2H2O | |
| C. | NH4HCO3溶液中加入足量澄清石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 向Ca(OH)2溶液中通入过量CO2:Ca2++2OH-+CO2=CaCO3↓+H2O |
15.下列实验操作或对实验事实的描述中正确的是( )
| A. | 燃着的酒精灯不慎碰翻失火,可立即用湿布盖灭 | |
| B. | 配制溶液的容量瓶要用欲配制的溶液润洗过 | |
| C. | 配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸 | |
| D. | 用托盘天平称量时,所称药品均可放在纸上,并置于天平的左盘 |
17.结构式为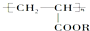 它属于( )
它属于( )
①无机化合物 ②有机化合物 ③高分子化合物 ④离子化合物 ⑤共价化合物.
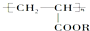 它属于( )
它属于( )①无机化合物 ②有机化合物 ③高分子化合物 ④离子化合物 ⑤共价化合物.
| A. | ①③④ | B. | ①③⑤ | C. | ②③⑤ | D. | ②③④ |
 2HClO+CO32—
2HClO+CO32— 4-甲基-3-乙基-2-己烯
4-甲基-3-乙基-2-己烯 2,2,3一三甲基戊烷
2,2,3一三甲基戊烷 .
.