题目内容
在常温常压下,水中溶解氧(DO)为9.17mg•L-1。当水体污染后,溶解氧减少,因此溶解氧是评价水质的重要指标。我国《地面水环境质量标准》规定:生活饮用水源的溶解氧不能低于5mg•L-1。测定水中溶解氧的方法是:①量取a mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使其充分反应,其反应为:2Mn2+O2+4OH-== 2MnO(OH)2。②测定:开塞后迅速加入1~2mL浓硫酸(提供H+),使之生成I2,再用c mol•L-1Na2S2O3溶液滴定(以淀粉溶液为指示剂),消耗VmL Na2S2O3溶液。有关反应为:MnO(OH)2+2I-+4H+ = Mn2++(1)求水中溶解氧(DO)的计算式(以mg•L-1为单位)。
(2)取某地水样10.35mL,按上述方法滴定,消耗9.841×10-3mol·L-1Na2S2O3标准溶液1.180mL。通过计算判断该水样是否符合饮用水标准。
答案:
解析:
解析:
| (1) 则有 从而得水中溶解氧的计算式DO=8×10-3cV g×103mg•g-1× (2) 将a =10.35mL、c = 9.841×10-3 mol•L-1、V=1.180L的数值代入上式得: DO = 8×103× 8.976mg•L-1>5mg•L-1,故该水样符合饮用水标准。
|

练习册系列答案
相关题目
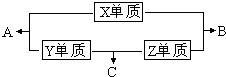 X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化: