题目内容
14.关于下列各实验装置图的叙述中,不正确的是( )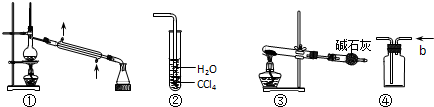
| A. | 装置①常用于分离某些互溶的液体混合物 | |
| B. | 装置②可用于吸收HCl气体,并防止倒吸 | |
| C. | 以NH4HCO3为原料,装置③可用于实验室制备少量NH3 | |
| D. | 装置④b口进气,可用排空气法收集H2、NO等气体 |
分析 A.互溶的液体采用分馏的方法分离;
B.有缓冲装置的能防止倒吸;
C.碳酸氢铵分解生成二氧化碳、水和氨气,碱石灰能吸收二氧化碳和水蒸气;
D.NO能和氧气反应生成二氧化氮.
解答 解:A.互溶的液体采用分馏的方法分离,所以装置①常用于分离某些互溶的液体混合物,其冷凝管中水流方向遵循“下进上出”原则,温度计测量蒸气温度,故A正确;
B.有缓冲装置的能防止倒吸,HCl极易溶于水不易溶于四氯化碳,所以该装置有缓冲作用,能防止倒吸,故B正确;
C.碳酸氢铵分解生成二氧化碳、水和氨气,碱石灰具有碱性,不吸收氨气,碱石灰能吸收二氧化碳和水蒸气,所以能用该装置制取少量氨气,故C正确;
D.NO能和氧气反应生成二氧化氮,所以不能用排气法收集NO,应该采用排水法收集,故D错误;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及物质分离和提纯、气体制备、气体收集等知识点,明确实验原理是解本题关键,从操作规范性及物质性质来分析解答,易错选项是D,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.有一种燃料电池,所用燃料为H2和空气,电解质为熔融的K2CO3.电池的总反应式为2H2+O2═2H2O,负极反应为H2+CO32--2e-═H2O+CO2.该电池放电时,下列说法中正确的( )
| A. | 正极反应为2CO2+O2+4e-═2CO32- | |
| B. | CO32-向正极移动 | |
| C. | 电子由正极经外电路流向负极 | |
| D. | 电池中CO32-的物质的量将逐渐减少 |
6.下列说法在一定条件下可以实现的是( )
①酸性氧化物与碱反应;
②弱酸与盐溶液反应可生成强酸;
③复分解反应既没有水生成,也没有沉淀和气体生成;
④两种酸溶液充分反应后的溶液呈中性;
⑤有单质参加的非氧化还原反应;
⑥两种含氧化合物反应的产物中有气体.
①酸性氧化物与碱反应;
②弱酸与盐溶液反应可生成强酸;
③复分解反应既没有水生成,也没有沉淀和气体生成;
④两种酸溶液充分反应后的溶液呈中性;
⑤有单质参加的非氧化还原反应;
⑥两种含氧化合物反应的产物中有气体.
| A. | ①②③④⑤⑥ | B. | ②④⑤⑥ | C. | ①②③⑤ | D. | ③④⑤⑥ |
8.化合物M是从微生物中分离得到的,它显示出广谱抗菌活性.下列关于化合物M的说法中错误的是( )


| A. | 化合物M的分子式为C14H15NO7 | |
| B. | 化合物M能使酸性KMnO4溶液褪色 | |
| C. | 化合物M能发生加成反应,不能发生消去反应 | |
| D. | 1mol在NaOH溶液中反应,最多消耗4molNaOH |
9.用NA表示阿伏加德罗常数,下列说法中正确的有( )
| A. | pH=13的NaOH溶液中含有的OH-的数为0.1 NA | |
| B. | Fe在少量Cl2中燃烧生成0.5 mol 产物,转移的电子数为1 NA | |
| C. | 18g D2O中含有的质子数为9NA | |
| D. | 标准状况下,含4 mol HCl的浓盐酸与足量MnO2加热反应可生成22.4 L氯气 |
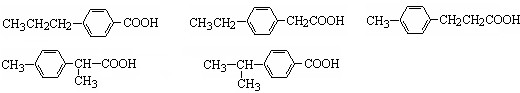 中任意两种.
中任意两种.

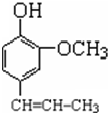 +CH3CH2Cl$\stackrel{一定条件下}{→}$
+CH3CH2Cl$\stackrel{一定条件下}{→}$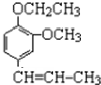 +HCl;
+HCl;