题目内容
|
某同学查阅有关资料得知:铁有δ-Fe、γ-Fe、α-Fe三种同素异形体.三种晶体在不同温度下能发生以下转化:
下列有关说法正确的是 | |
| [ ] | |
A. |
构成它们的原子大小不同 |
B. |
δ-Fe、γ-Fe、α-Fe一定由不同种类的铁原子构成 |
C. |
δ-Fe、γ-Fe、α-Fe之间的相互转化是物理变化 |
D. |
δ-Fe、γ-Fe、α-Fe里铁原子的排列不同 |
答案:D
解析:
解析:
|
|

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

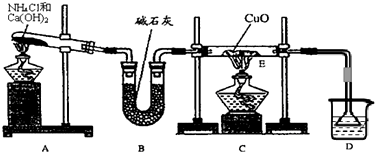



 CO↑+H2O 请根据以下各装置进行选择组成一套相对较为合理的实验装置图(某些装置可重复使用)
CO↑+H2O 请根据以下各装置进行选择组成一套相对较为合理的实验装置图(某些装置可重复使用) 
