题目内容
17.甲、乙、丙三种物质均由短周期元素组成,一定条件下,存在下列转化关系:甲+乙→丙+H20(1)若丙为Na2C03,反应的化学方程式为CO2+2NaOH=Na2C03+H2O(任写一个).
0.1mol•L-1Na2CO3溶液中,所含的离子按物质的量浓度由大到小的顺序排列为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
(2)若甲是石油裂解气的主要成分之一,乙为O2,且甲分子和乙分子具有相同的电子数.25℃、101kPa时,1g甲完全燃烧生成CO2气体与液态水,放出50.5kJ的热量,该反应的热化学方程式为C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1414KJ/mol;利用该反应设计的燃料电池中,通入甲的电极为电池的负极(填“正极”或“负极”).
(3)若甲、乙是同主族元素的化合物,丙为单质.
①丙所含元素在元素周期表中的位置为第三周期第ⅥA族
②甲与水相比,热稳定性较强的是H2O(填化学式).
分析 (1)甲+乙→丙+H20,丙为Na2C03,则可能为CO2与NaOH的反应;碳酸钠溶液水解显碱性;
(2)甲是石油裂解气的主要成分之一,乙为O2,且甲分子和乙分子具有相同的电子数,则甲为C2H4,25℃、101kPa时,1g甲完全燃烧生成CO2气体与液态水,放出50.5kJ的热量,则1molC2H4完全燃烧放出50.5×28=-1414kJ的热量;该反应设计的燃料电池中,通入甲的电极上C失去电子;
(3)若甲、乙是同主族元素的化合物,丙为单质,反应为2H2S+SO2=3S+2H2O,则丙为S,非金属性越强,氢化物越稳定.
解答 解:(1)甲+乙→丙+H20,丙为Na2C03,则可能为CO2与NaOH的反应,反应为CO2+2NaOH=Na2C03+H2O;碳酸钠溶液水解显碱性,应有c(OH-)>c(H+),CO32-两步水解以第一步为主,且水解程度小,所以离子的物质的量浓度由大到小顺序排列为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),
故答案为:CO2+2NaOH=Na2C03+H2O;c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
(2)甲是石油裂解气的主要成分之一,乙为O2,且甲分子和乙分子具有相同的电子数,则甲为C2H4,25℃、101kPa时,1g甲完全燃烧生成CO2气体与液态水,放出50.5kJ的热量,则1molC2H4完全燃烧放出50.5×28=-1414kJ的热量,则乙烯燃烧的热化学方程式为C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1414KJ/mol;该反应设计的燃料电池中,通入甲的电极上C失去电子,发生氧化反应,则为原电池的负极,
故答案为:C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1414KJ/mol;负极;
(3)若甲、乙是同主族元素的化合物,丙为单质,反应为2H2S+SO2=3S+2H2O,则丙为S,在元素周期表中的位置为第三周期第ⅥA族,非金属性O>S,热稳定性较强的是H2O,故答案为:第三周期第ⅥA族;H2O.
点评 本题考查无机物的推断,为高频考点,把握反应的特点推断物质及元素为解答的关键,涉及离子浓度大小比较、热化学方程式及原电池等,侧重分析、推断及反应原理的考查,综合性较强,题目难度中等.

| A. | 苯的二元取代物无同分异构体 | B. | 苯的邻位二元取代物只有一种 | ||
| C. | 苯的间位二元取代物只有一种 | D. | 苯的对位二元取代物只有一种 |
| A. | 碳酸钠溶液与稀盐酸混合 | B. | 硫酸钠溶液与氯化钾溶液混合 | ||
| C. | 稀硫酸与氢氧化钠溶液混合 | D. | 氢氧化钠溶液与硫酸铜溶液混合 |
| A. | 金属单质 | B. | 非金属单质 | C. | 可溶性碱 | D. | 可溶性盐 |
| A. | 18gH20中含NA个质子 | |
| B. | 1L 1mol•L一1的CuSO4溶液中含NA个Cu2+ | |
| C. | 常温常压下,2.24L Cl2中含0.2NA个氯原子 | |
| D. | 0.5mol Al与足量NaOH溶液充分反应,转移的电子数目为1.5NA |
| A. | 5n-2 | B. | 12-3n | C. | 3n-12 | D. | 3n-6 |
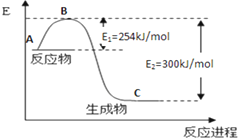 氮是地球上含量丰富的一种元素,氮及其化合物在工 农业生产、生活中有着重要作用,
氮是地球上含量丰富的一种元素,氮及其化合物在工 农业生产、生活中有着重要作用,(1)如图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92.2KJ/mol.
(2)若已知下列数据:
| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
(3)合成氨反应通常用铁触媒作催化剂.使用铁触媒后△H不变 (填“增大”、“减小”、“不变”)
(4)用NH3催化还原NOX 氮氧化物的污染.例如
4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H1=akJ•mol-1
N2(g)+O2(g)=2NO(g)△H2=bkJ/mol
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3=$\frac{a-3b}{4}$kJ/mol(用含a、b的式子表示)
| A. | 10% | B. | 25% | C. | 50% | D. | 75% |