题目内容
如图4-15所示的两个装置中,溶液的体积均为200 mL,开始时电解质溶液的浓度均为0.1 mol·L-1,工作一段时间后,测得导线上通过0.02 mol 电子,若不考虑盐的水解和溶液的体积变化,则下列叙述正确的是( ) 
图4-15
A.产生气体的体积①>②
B.电极上析出固体物质的质量①>②
C.溶液pH变化①增大②减少
D.电极反应式:①中阳极:4OH--4e-![]() 2H2O+O2↑
2H2O+O2↑
②中负极2H++2e-![]() H2↑
H2↑
思路解析:①为电解CuSO4溶液,两极反应分别为:
阴极:2Cu2++4e-![]() 2Cu
2Cu
阳极:4OH--4e-![]() 2H2O+O2↑
2H2O+O2↑
总反应式为:2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑
2Cu+2H2SO4+O2↑
②为原电池,两极反应为:
负极:Zn-2e-![]() Zn2+
Zn2+
正极:2H++2e-![]() H2↑
H2↑
总反应式为:Zn+H2SO4  ZnSO4+H2↑
ZnSO4+H2↑
当通过0.02 mol 电子时,①中阳极产生0.005 mol O2,②中产生0.01 mol H2;①中阴极析出0.01 mol Cu,②中没有固体析出:①电解后有H2SO4生成,溶液pH变小,②消耗H2SO4,溶液pH变大。
答案:B

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
(13分)实验室需要0.1 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________________(填仪器名称)。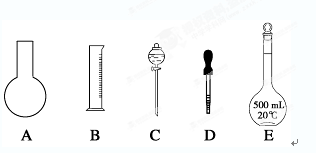
(2)下列操作中,容量瓶所不具备的功能有________(填序号)。
| A.配制一定体积准确浓度的标准溶液 |
| B.贮存溶液 |
| C.测量容量瓶规格以下的任意体积的液体 |
| D.准确稀释某一浓度的溶液 |
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.1 mol/L(填“大于”、“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度_______0.1 mol/L。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为__________mL(计算结果保留一位小数)。如果实验室有15 mL、20 mL、50 mL量筒,应选用________mL量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是_____________________________。
 (I)滴定分析法是化学分析法中的重要分析方法之一.
(I)滴定分析法是化学分析法中的重要分析方法之一.

 A-F六种元素中,除A外均为短周期元素,它们的原子结构或性质如表所示:
A-F六种元素中,除A外均为短周期元素,它们的原子结构或性质如表所示: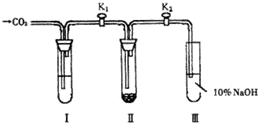 为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验:
为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验: