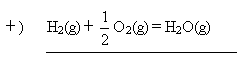题目内容
把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g) CO2(g)(放热Q1 kJ)
CO2(g)(放热Q1 kJ)
途径Ⅱ:

以上两途径燃烧的C的质量相同,试回答下列问题:
(1)判断两途径放热:途径Ⅰ放出的热量________(填“大于”、“等于”、“小于”)途径Ⅱ放出的热量.
(2)Q1,Q2,Q3的数学关系式为:________.
(3)由于制取水煤气反应里,反应物所具有的总能量________生成物具有的总能量,那么在化学反应时需要________能量才能转化为生成物,因此其反应条件为________.
(4)简述煤通过途径Ⅱ作为燃料的意义:________________________________.
答案:
解析:
解析:
|
(1)等于 (2)Q1=Q3-Q2 (3)低于,吸收,高温 (4)固体煤经处理变为气体燃料后,不仅在燃烧时可以大大减少SO2和烟尘对大气的污染,而且燃烧效率高,也便于输送 导解:途径Ⅰ中一定量的C燃烧放出的热量已确定为Q1 kJ,此时应分析同样量的C通过途径Ⅱ燃烧后,最终放出的热量与Q1 kJ是否相等.将途径Ⅱ的几步反应叠加: C(s)+H2O(g)=CO(g)+H2(g) CO(g)+
C(s)+O2(g)=CO2(g) 所得总反应式与途径Ⅰ完全相同,即途径Ⅱ发生的反应相当于C直接燃烧,即两途径放出的总热量相等. 因途径Ⅱ放出的热量为(Q3-Q2)kJ,故Q1,Q2,Q3三者之间存在关系式Q1=Q3-Q2. 虽然反应为吸热或放热与反应条件是否加热没有必然的关系,但通常吸热反应需持续加热才能维持. 途径Ⅱ的实质是将固体煤转变为气体燃料的一种工业处理方法,其优点在教材中的相应部分有详细的叙述. |

练习册系列答案
相关题目
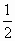 O2(g)=CO2(g)
O2(g)=CO2(g)