题目内容
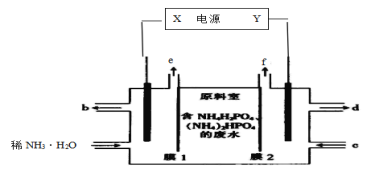
【题目】利用如图装置从含NH4H2PO4和(NH4)2HPO4的废水中回收NH3·H2O和H3PO4,下列说法错误的是( )
A.电源中X和Y两电极的电势X比Y低
B.膜1为阳离子交换膜,f口放出的是O2
C.阳极区反应之一为:2H2O-4e-+2HPO![]() =O2↑+2H3PO4
=O2↑+2H3PO4
D.每放出11.2L(标准状况下)H2时,能回收98gH3PO4
【答案】D
【解析】
利用如图装置从含NH4H2PO4和(NH4)2HPO4的废水中回收NH3·H2O和H3PO4,则电解池两端一边生产NH3·H2O,一边产生H3PO4,根据图示,可得左端通入稀NH3·H2O,b流出的为浓度较大的NH3·H2O;右端c通入的为稀H3PO4,则d流出的为浓度较大的H3PO4,原料室中的NH4+向左端移动,与OH-结合生产NH3·H2O,即左端电极为阴极,电解水产生H2和OH-,电极反应为:2H2O+2e-=2OH-+H2↑;原料室中的HPO42-、H2PO4-向右端移动,与H+结合形成H3PO4,则右端为阳极,阳极附近是OH-放电,生成O2,电极反应为:2H2O-4e-=O2↑+4H+;则e口放出的为H2,f口放出的为O2,电解池的阴极与电源负极相连,阳极与电源正极相连,则X为电源负极,Y为电源正极,据此分析解答。
A.根据分析,X为电源负极,Y为电源正极,外电路中,电流从正极流向负极,在电场力作用下,电流由高电势向低电势运动,则电源中X和Y两电极的电势X比Y低,故A正确;
B.根据分析,原料室中的NH4+向左端移动,膜1为阳离子交换膜,阳极发生的电极反应为:2H2O-4e-=O2↑+4H+,f口放出的是O2,故B正确;
C.根据分析,阳极发生的电极反应为:2H2O-4e-=O2↑+4H+,原料室中的HPO42-、H2PO4-向右端移动,与H+结合形成H3PO4,阳极区发生总反应为:2H2O-4e-+2HPO42-=O2↑+2H3PO4,2H2O-4e-+4 H2PO4-=O2↑+4H3PO4,故C正确;
D.每放出11.2L(标准状况)H2时,结合阴极电极反应2H2O+2e-=2OH-+H2↑;则转![]() ×2=1mol电子,阳极区发生总反应为:2H2O-4e-+2HPO42-=O2↑+2H3PO4,2H2O-4e-+4H2PO4-=O2↑+4H3PO4,所以将有1molH2PO4或者0.5molHPO42移到阳极区,所以能回收H3PO4小于1mol,质量小于98g,故D错误;
×2=1mol电子,阳极区发生总反应为:2H2O-4e-+2HPO42-=O2↑+2H3PO4,2H2O-4e-+4H2PO4-=O2↑+4H3PO4,所以将有1molH2PO4或者0.5molHPO42移到阳极区,所以能回收H3PO4小于1mol,质量小于98g,故D错误;
答案选D。

 阅读快车系列答案
阅读快车系列答案