题目内容
对于可逆反应N2(g)+3H2(g)  2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
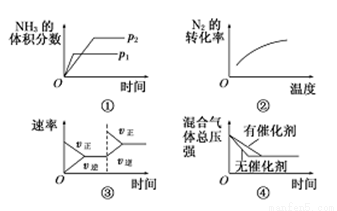
A.①压强对反应的影响(p2>p1)
B.②温度对反应的影响
C.③平衡体系增加N2对反应的影响
D.④催化剂对反应的影响
钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质)。

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是 。
(2)写出步骤Ⅱ中Co2O3与盐酸反应的离子方程式 。有同学认为Ⅱ中将盐酸换成硫酸和H2O2溶液更好,请结合离子方程式说明理由 。
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过__________。废渣中的成分有_________________。
(4)在空气中加热CoC2O4固体,经测定,210~290℃的过程中只产生CO2和一种二元化合物,该化合物中钴元素的质量分数为73.44%。此过程发生反应的化学方程式是_______________。
(5)某锂离子电池的总反应为C6+LiCoO2  LixC6+Li1-xCoO2,LixC6中Li的化合价为______价,该锂离子电池充电时阳极的电极反应式为 。
LixC6+Li1-xCoO2,LixC6中Li的化合价为______价,该锂离子电池充电时阳极的电极反应式为 。
下列生产或实验事实得出的相应结论不正确的是
选项 | 事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | A、B两支试管,各加入4mL0.01mol/L的KMnO4酸性溶液,在A试管中加入2mL0.01mol/LH2C2O4溶液和在B试管中加入4mL 0.02mol/L的H2C2O4溶液,记录溶液褪色所需时间,B试管褪色时间短 | 当其他条件不变时,增大反应物浓度,化学反应速率加快 |
C | 在容积可变的密闭容器中发生反应:2NH3(g) | 正反应速率加快,逆反应速率减慢 |
D | A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |


 的是( )
的是( ) 2SO3(g) ΔH=-197 kJ·mol-1.向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙)1 mol SO2和0.5 mol O2;(丙)2 mol SO3.恒温、恒容下反应达平衡时,下列关系一定正确的是
2SO3(g) ΔH=-197 kJ·mol-1.向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙)1 mol SO2和0.5 mol O2;(丙)2 mol SO3.恒温、恒容下反应达平衡时,下列关系一定正确的是 N2H4(l)+H2(g),把容器的体积缩小一半
N2H4(l)+H2(g),把容器的体积缩小一半 2AB ΔH=QkJ/mol。在不同温度和压强改变条件下,产物AB的生成情况如图所示:a为500℃,b为300℃时的情况,c为300℃时从时间t3开始向容器加压的情况,则下列叙述正确的是
2AB ΔH=QkJ/mol。在不同温度和压强改变条件下,产物AB的生成情况如图所示:a为500℃,b为300℃时的情况,c为300℃时从时间t3开始向容器加压的情况,则下列叙述正确的是
 H2S(g) K1
H2S(g) K1