题目内容
8.糕点(如月饼)包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同.下列分析正确的是( )| A. | 脱氧过程是吸热反应,可降低温度,延长糕点保质期 | |
| B. | 脱氧过程中铁作原电池正极,电极反应为:Fe-3e-=Fe3+ | |
| C. | 脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-═4OH- | |
| D. | 含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
分析 铁粉、氯化钠溶液、炭粉构成原电池,铁作负极,碳作正极,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应,原电池放电过程是放热反应,结合得失电子相等进行有关计算.
解答 解:铁粉、氯化钠溶液、炭粉构成原电池,铁作负极,碳作正极,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应,原电池放电过程是放热反应,
A.铁粉、氯化钠溶液、炭粉构成原电池,原电池放电过程是放热反应,故A错误;
B.脱氧过程中铁作原电池负极,负极上铁失电子生成亚铁离子,电极反应为:Fe-2e-=Fe2+,故B错误;
C.脱氧过程中碳做原电池正极,电极反应O2+2H2O+4e-=4OH-,故C错误;
D.由电子守恒知,还原性铁粉最终会被氧化为+3价,所以1.12gFe完全氧化注意电子的物质的量为:$\frac{1.12g}{56g/mol}$×3=0.06mol,每消耗1mol氧气转移4mol电子,所以消耗氧气物质的量为:$\frac{0.06mol}{4}$=0.015mol,标准状况下v(O2)=0.015mol×22.4L/mol=0.336L=336mL,故D正确;
故选D.
点评 本题考查了原电池原理,明确正负极的判断、正负极上得失电子、物质间的反应来分析解答即可,注意D选项铁最终被氧化成三价铁,难度中等.

练习册系列答案
相关题目
1.下列实验方案、现象与实验结论不正确的是( )
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向Fe(NO3)3溶液中通入SO2,滴加BaCl2溶液; 产生白色沉淀 | NO3-在酸性条件下能氧化SO2生成SO42- |
| B | 向Fe(NO3)2溶液中滴加少量盐酸; 浅绿色变深绿色 | 溶液中存在Fe2+水解平衡移动 |
| C | 向沸水中滴加FeCl3饱和溶液,煮沸得红褐色液体;用激光灯照射液体,有一条明亮“通路” | 该液体分散质直径介于1nm与100nm之间 |
| D | 向FeI2溶液中滴加酸化的双氧水和淀粉溶液;溶液为蓝色 | Fe2+的还原性比I-的还原性弱 |
| A. | A | B. | B | C. | C | D. | D |
19.下列有关命名的说法正确的是( )
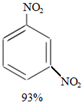
| A. | 按系统命名法,有机物 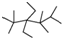 的命名为2,3,3,5,5五甲基-4,4-二乙基己烷 的命名为2,3,3,5,5五甲基-4,4-二乙基己烷 | |
| B. |  主链上的碳原子数是5 主链上的碳原子数是5 | |
| C. | 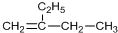 加氢后可以得到3-甲基戊烷 加氢后可以得到3-甲基戊烷 | |
| D. |  的名称是1,3,4-三甲基苯 的名称是1,3,4-三甲基苯 |
16. 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂.
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂.
制备硝基苯的过程如下:
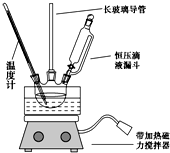
①组装如图反应装置.配制混酸,取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混酸,加入漏斗中,把18mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀.
③在50~60℃下发生反应,直至反应结束.
③除去混酸后,粗产品依次用蒸馏水和10% Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
已知(1)
 HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50~60℃}$
HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50~60℃}$ +H2O
+H2O
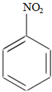 +HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{95℃}$
+HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{95℃}$ +
+ +
+
(2)可能用到的有关数据列表如下
请回答下列问题:
(1)配制混酸应在烧杯中先加入浓硝酸.
(2)恒压滴液漏斗的优点是可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下.
(3)实验装置中长玻璃管可用冷凝管(球形冷凝管或直行冷凝管均可)代替(填仪器名称).
(4)反应结束后,分离混酸和产品的操作方法为分液.
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净.
(6)为了得到更纯净的硝基苯,还需先向液体中加入CaCl2(填化学式)除去水,然后采取的实验操作是蒸馏.
 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂.
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂.制备硝基苯的过程如下:
①组装如图反应装置.配制混酸,取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混酸,加入漏斗中,把18mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀.
③在50~60℃下发生反应,直至反应结束.
③除去混酸后,粗产品依次用蒸馏水和10% Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
已知(1)
 HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50~60℃}$
HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50~60℃}$ +H2O
+H2O +HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{95℃}$
+HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{95℃}$ +
+ +
+
(2)可能用到的有关数据列表如下
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃) | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸[来] | - | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | - | 338 | 1.84 | 易溶于水 |
(1)配制混酸应在烧杯中先加入浓硝酸.
(2)恒压滴液漏斗的优点是可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下.
(3)实验装置中长玻璃管可用冷凝管(球形冷凝管或直行冷凝管均可)代替(填仪器名称).
(4)反应结束后,分离混酸和产品的操作方法为分液.
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净.
(6)为了得到更纯净的硝基苯,还需先向液体中加入CaCl2(填化学式)除去水,然后采取的实验操作是蒸馏.
17.X、Y、Z、W是原子序数依次增大的四种短周期元素,已知X、Z,Y、W分别位于同一主族,X与Z形成的离子化合物能与X、Y形成的常见液态共价化合物反应生成X2单质,Y、W两元素可形成两种常见的化合物,以下说法正确的是( )
| A. | X、Y、Z、W四种元素形成的化合物,其水溶液一定显强酸性 | |
| B. | Y、W的氢化物的稳定性后者强于前者 | |
| C. | X、Y、Z、W形成的简单离子半径大小依次增大 | |
| D. | Z的单质可与X、Y形成的共价化合物反应生成X2单质 |
18.下列指定反应的离子方程式正确的是( )
| A. | 向Mg (HCO3)2溶液中,加入过量的澄清石灰水:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+MgCO3↓+2H2O | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全:NH4++2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| C. | 向2mL 1mo1/L Fe(NO3)2溶液中加等体积等物质的量浓度的氢碘酸:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O | |
| D. | CuC12溶液中加入H2S溶液:Cu2++S2-═CuS↓ |

 X、Y、Z、W为短周期的主族元素,其原子序数依次增大.X元素形成的单质是自然界中含量最多的气体.Y是电负性最大的元素.W的原子最外层电子数与核外电子总数之比为3:8.X的原子序数是Z的原子序数的一半.U是第四周期11列元素.
X、Y、Z、W为短周期的主族元素,其原子序数依次增大.X元素形成的单质是自然界中含量最多的气体.Y是电负性最大的元素.W的原子最外层电子数与核外电子总数之比为3:8.X的原子序数是Z的原子序数的一半.U是第四周期11列元素.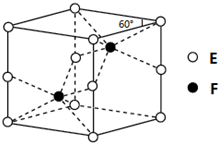 A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大.A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,D元素的价电子数是其余电子数的一半,C与B同主族,A与F同主族,D与E同族.回答下列问题:
A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大.A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,D元素的价电子数是其余电子数的一半,C与B同主族,A与F同主族,D与E同族.回答下列问题: