题目内容
12.(1)除去SiO2固体中混有的Al2O3,其离子方程式为:Al2O3+6H+=2Al3++3H2O.(2)除去FeCl2溶液中的少量FeCl3,其离子方程式为:2Fe3++Fe=3Fe2+.
(3)除去NaHCO3溶液中的少量Na2CO3,其离子方程式为:CO2+CO32-+H2O=2HCO3-.
分析 (1)氧化铝是两性氧化物和盐酸反应,二氧化硅是酸性氧化物不与盐酸反应;
(2)氯化铁溶液和铁反应生成氯化亚铁;
(3)碳酸钠、水、二氧化碳反应生成碳酸氢钠.
解答 解:(1)氧化铝是两性氧化物和盐酸反应,二氧化硅是酸性氧化物和盐酸不反应,除去SiO2固体中混有的Al2O3,方法是:加入过量盐酸溶解后过滤得到二氧化硅,反应的离子方程式Al2O3+6H+=2Al3++3H2O;
故答案为:Al2O3+6H+=2Al3++3H2O;
(2)氯化铁溶液和铁反应生成氯化亚铁,除去氯化亚铁溶液中的氯化铁方法为:加入足量铁粉过滤,反应的离子方程式为2Fe3++Fe=3Fe2+;
故答案为:2Fe3++Fe=3Fe2+;
(3)除去NaHCO3溶液中的少量Na2CO3,其离子方程式为CO2+CO32-+H2O=2HCO3-,故答案为:CO2+CO32-+H2O=2HCO3-.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及除杂原则为解答的关键,侧重分析与应用能力的考查,注意物质的特性,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.学习化学反应速率时,我们可以用物理上的速率知识来大胆类推学习,二者在许多方面都是极其相似的.下列关于化学反应速率的说法中,不正确的是( )
| A. | 化学反应速率是衡量化学反应进行快慢程度的物理量 | |
| B. | 化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示 | |
| C. | 在同一个反应中,用各物质表示的反应速率之比等于其化学方程式中的化学计量数之比 | |
| D. | 化学反应速率的常用单位有mol•L-1•s-1和mol/(L•min) |
11.铁及碳的化合物在社会生产、生活中有着广泛的应用.请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一.
已知:①Fe3O4(s)+4C(s)?3Fe(s)+4CO(g)△H=+646.0kJ•mol-1
②C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1
则Fe3O4(s)+4CO(g)?3Fe(s)+4CO2(g)△H=-44.0kJ/mol.
(2)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H的平衡常数为K,在不同温度下,K值如下:
①从表中数据可推断,该反应是吸热(填“放热”或“吸热”)反应.
②温度为973K时,在某恒容密闭容器中发生上述反应.下列有关说法能说明该反应已达到平衡状态的是BD(填字母).
A.c(CO2)=c(CO) B.v正(CO2)=v逆(CO)
C.体系压强不变 D.混合气体中c(CO)不变
(3)如图图1、2表示反应:H2(g)+CO2(g)?CO(g)+H2O(g)△H>0有关量与反应时间之间的关系:
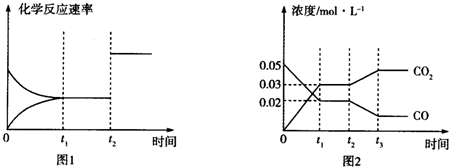
①图2中若t1=0.5min,则0~t1时间段内,H2O的平均反应速率v(H2O)=0.006mol•L-1•s-1.
②图1中t2时刻改变的条件是加入催化剂或增大压强(任写两种,下同);图2中t2时刻改变的条件是降低温度或增大水蒸气浓度或减小氢气浓度.
(4)水煤气中的CO和H2均可作为燃料电池的燃料.若在某燃料电池一极通入CO,另一极通入O2和CO2,熔融碳酸钠作为电解质,工作时负极反应式为CO+CO32--2e-=2CO2;若使用该电池电解熔融Al2O3制取10.8g Al,则理论上需要氧气的体积为6.72L
(标准状况下).
(1)磁铁矿是工业上冶炼铁的原料之一.
已知:①Fe3O4(s)+4C(s)?3Fe(s)+4CO(g)△H=+646.0kJ•mol-1
②C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1
则Fe3O4(s)+4CO(g)?3Fe(s)+4CO2(g)△H=-44.0kJ/mol.
(2)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H的平衡常数为K,在不同温度下,K值如下:
| 温度/K | 973 | 1173 | 1373 | 1573 |
| K | 1.47 | 2.15 | 3.36 | 8.92 |
②温度为973K时,在某恒容密闭容器中发生上述反应.下列有关说法能说明该反应已达到平衡状态的是BD(填字母).
A.c(CO2)=c(CO) B.v正(CO2)=v逆(CO)
C.体系压强不变 D.混合气体中c(CO)不变
(3)如图图1、2表示反应:H2(g)+CO2(g)?CO(g)+H2O(g)△H>0有关量与反应时间之间的关系:

①图2中若t1=0.5min,则0~t1时间段内,H2O的平均反应速率v(H2O)=0.006mol•L-1•s-1.
②图1中t2时刻改变的条件是加入催化剂或增大压强(任写两种,下同);图2中t2时刻改变的条件是降低温度或增大水蒸气浓度或减小氢气浓度.
(4)水煤气中的CO和H2均可作为燃料电池的燃料.若在某燃料电池一极通入CO,另一极通入O2和CO2,熔融碳酸钠作为电解质,工作时负极反应式为CO+CO32--2e-=2CO2;若使用该电池电解熔融Al2O3制取10.8g Al,则理论上需要氧气的体积为6.72L
(标准状况下).
17.在水溶液中进行反应3KSCN+FeCl3?Fe(SCN)3+3KCl,当达到平衡时,下列说法错误的是( )
| A. | 加水稀释,平衡左移,溶液颜色变浅 | |
| B. | 加入一定量的NaOH溶液,有红褐色沉淀产生,溶液颜色变浅 | |
| C. | 加入一定量的铁粉,充分振荡后,溶液颜色变浅 | |
| D. | 加入少量的KCl固体,平衡左移,溶液颜色变浅 |
4.下列实验中,所采取的实验方法(或操作)与对应的原理都正确的是( )
| 选项 | 实验 | 方法(或操作) | 原理 |
| A | 分离溶于水中的溴 | 裂解汽油萃取 | 碘在裂解汽油中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 从蛋清中提取蛋白质 | 加入硫酸铜溶液 | 浓盐溶液使蛋白质溶解度降低 |
| D | 尿液中尿糖的检验 | 加入新制Cu(OH)2、加热 | 葡萄糖具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
1.下列过程放出热量的是( )
| A. | 钠与水反应 | B. | 液氨气化 | ||
| C. | Ba(OH)2•8H2O晶体与NH4Cl晶体反应 | D. | 碳酸钙分解 |
2.在给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
| A. | Al(OH)3$\stackrel{盐酸}{→}$AlCl3(aq)$\stackrel{蒸发}{→}$无水AlCl3 | |
| B. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{Cu}{→}$Fe | |
| C. | NaOH(aq)$\stackrel{CuSO_{4}(aq)}{→}$Cu(OH)2$→_{△}^{葡萄糖}$Cu2O | |
| D. | NH3$→_{催化剂}^{O_{2},△}$NO2$\stackrel{H_{2}O}{→}$HNO3 |
