题目内容
白磷会对人体造成严重的烧伤,白磷(P4)分子结构为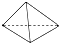 .2009年1月11日,国际人权组织--人权观察曾在其报告中指责以色列在加沙人口稠密地区使用了违禁武器.该组织在报告中指出,以军在轰炸和炮击加沙地区时使用了白磷炸弹.下列说法不正确的是( )
.2009年1月11日,国际人权组织--人权观察曾在其报告中指责以色列在加沙人口稠密地区使用了违禁武器.该组织在报告中指出,以军在轰炸和炮击加沙地区时使用了白磷炸弹.下列说法不正确的是( )
 .2009年1月11日,国际人权组织--人权观察曾在其报告中指责以色列在加沙人口稠密地区使用了违禁武器.该组织在报告中指出,以军在轰炸和炮击加沙地区时使用了白磷炸弹.下列说法不正确的是( )
.2009年1月11日,国际人权组织--人权观察曾在其报告中指责以色列在加沙人口稠密地区使用了违禁武器.该组织在报告中指出,以军在轰炸和炮击加沙地区时使用了白磷炸弹.下列说法不正确的是( )| A、白磷着火点低,在空气中可自燃 |
| B、白磷、红磷为同素异形体 |
| C、31 g白磷中,含P-P键1.5 mol |
| D、已知P4(白磷)+3O2(g)═2P2O3(s)△H=-Q kJ?mol-1,则白磷的燃烧热为Q kJ?mol-1 |
考点:燃烧热,同素异形体,磷
专题:
分析:A、白磷的着火点只有40℃;
B、由同种元素形成的不同单质互称同素异形体;
C、31g白磷有1molP,1mol白磷含6mol共价键4molP原子,据此分析;
D、燃烧热是指1mol物质完全燃烧生成稳定化合物时放出的热量.
B、由同种元素形成的不同单质互称同素异形体;
C、31g白磷有1molP,1mol白磷含6mol共价键4molP原子,据此分析;
D、燃烧热是指1mol物质完全燃烧生成稳定化合物时放出的热量.
解答:
解:A、白磷的着火点只有40℃,所以在空气中能够自燃,故A正确;
B、白磷和红磷是有同种元素组成的不同单质,互为同素异形体,故B正确;
C、1mol白磷含6mol共价键4molP原子,1molP原子平均1.5molP-P键,31g白磷有1molP原子,故C正确;
D、P的燃烧热是指生成稳定化合物P2O5时放出的热量,故D错误;
故选D.
B、白磷和红磷是有同种元素组成的不同单质,互为同素异形体,故B正确;
C、1mol白磷含6mol共价键4molP原子,1molP原子平均1.5molP-P键,31g白磷有1molP原子,故C正确;
D、P的燃烧热是指生成稳定化合物P2O5时放出的热量,故D错误;
故选D.
点评:本题考查了白磷的着火点、同素异形体、白磷的分子结构、燃烧热,题目难度中等.

练习册系列答案
相关题目
在室温下,某一元弱酸HA的电离常数为Ka,盐NaA的水解常数为Kh.下列关于Ka和Kh的关系式中,正确的是( )
| A、Ka=-Kh |
| B、Ka=Kh-1 |
| C、Ka?Kh=Kw |
| D、Ka?Kw=Kh |
反应C+CO2?2CO;△H>0,正反应速率v1,逆反应速率v2,达平衡后,升高温度,下列叙述正确的是( )
| A、v1减小,v2增大,平衡逆向移动 |
| B、v1增大,v2减小,平衡正向移动 |
| C、v1、v2同时减小,平衡逆向移动 |
| D、v1、v2同时增大,平衡正向移动 |
进行化学实验必须注意安全,下列说法不正确的是( )
| A、将鼻孔凑到集气瓶口闻气体的气味 |
| B、不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 |
| C、不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| D、酒精灯着火时用湿抹布盖灭 |
某无色溶液能与铝反应放出氢气,则该溶液中肯定不能大量共存的离子组是( )
| A、NH4+、Na+、Ba2+、Cl- |
| B、Na+、I-、HCO3-、SO42- |
| C、K+、Cl-、SO32-、AlO2- |
| D、Na+、Mg2+、SO42-、Cl- |
下列叙述中正确的是( )
| A、25°时,在pH=0的溶液中,NO3-、SO42-、I-、K+可以大量共存 |
| B、物质的量浓度相等的Na2CO3和NaHCO3溶液,其25°时,pH是pH(Na2CO3)<pH(NaHCO3) |
| C、FeBr2溶液中通入少量Cl2时,离子方程式为2Br-+Cl2═2Cl-+Br2 |
| D、醋酸与NaOH发生中和反应时,当c(CH3COO-)=c(Na+)时,c(H+)=c(OH?) |
 乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成.乙醇和汽油经加工处理形成的车用燃料即乙醇汽油.
乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成.乙醇和汽油经加工处理形成的车用燃料即乙醇汽油.