题目内容
16.工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱.请回答下列问题:(1)卢布兰芳是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱.
①食盐和浓硫酸反应的化学方程式为Na2SO4+4C+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaS+Na2CO3+2CO2;
②硫酸钠和焦炭、石灰石反应的化学方程式为Na2SO4+4C+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaS+Na2CO3+2CO2(已知产物之一为CaS);
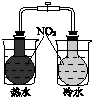
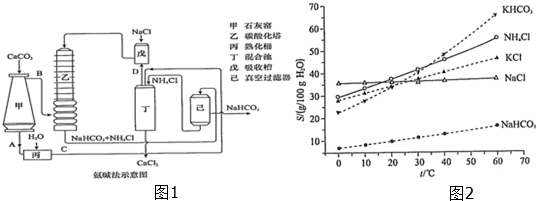
(2)氨碱法的工艺如图1所示,得到的碳酸氢钠经煅烧生成纯碱.
①图1中的中间产物C是Ca(OH)2,DNH3.(写化学式);
②装置乙中发生反应的化学方程式为NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl;
(3)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾.请结合图2的溶解度(S)随温度变化曲线,分析说明是否可行?不可行,因为KHCO3的溶解度较大,且在常温下与KCl溶解度相差小,在铵盐水碳酸化时无法大量析出.
(4)某工厂用氨制硝酸,再进一步制NH4NO3.已知由NH3制HNO3时产率为88%,由NH3被HNO3的吸收率为98%.则该工厂用100吨氨最多能制硝酸铵218吨.(计算结果保留整数)
分析 (1)①98%浓硫酸为高沸点酸,能制取低沸点的酸氯化氢,食盐和浓硫酸反应生成氯化氢和硫酸钠;
②由题目信息可知,硫酸钠与石灰石、焦炭反应生成CaS、Na2CO3,根据元素守恒可知,还原C的氧化物CO或CO2生成;
(2)①碳酸钙加热分解生成CaO与CO2,故A为CaO,B为CO2,CaO在熟化桶内与水反应生成氢氧化钙;氢氧化钙与氯化铵在混合池内反应生成氨气与氯化钙;
②氨气与氯化钠溶液混合后,在乙中与二氧化碳发生反应,生成NaHCO3、NH4Cl;
(3)KHCO3和NH4Cl的溶解度相差不大,当温度高于40℃时,KHCO3的溶解度大于NH4Cl,降温结晶时会析出较多的KCl;
(4)设出制备出的硝酸铵的物质的量为xmol,然后根据在反应过程中的损耗,将NH4NO3时所需的NH3的物质的量和制备HNO3时所需的NH3的分别表示出,质量共为100t,据此进行求算.
解答 解:(1)①利用高沸点酸制备挥发性酸,且HCl极易溶于水,故利用直接使用98%浓硫酸和氯化钠制取氯化氢,反应为:NaCl+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HCl↑或2NaCl+H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl↑,
故答案为:NaCl+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HCl↑或2NaCl+H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl↑;
②由题目信息可知,硫酸钠与石灰石、焦炭反应生成CaS、Na2CO3,根据元素守恒可知,还原C的氧化物CO或CO2生成,故反应方程式为:Na2SO4+4C+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaS+Na2CO3+2CO2,
故答案为:Na2SO4+4C+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaS+Na2CO3+2CO2;
(2)①碳酸钙加热分解生成CaO与CO2,故A为CaO,B为CO2,CaO在熟化桶内与水反应生成氢氧化钙,故C为Ca(OH)2;氢氧化钙与氯化铵在混合池内反应生成氨气与氯化钙,故D为NH3,
故答案为:Ca(OH)2;NH3;
②氨气与氯化钠溶液混合后,在乙中与二氧化碳发生反应,生成NaHCO3、NH4Cl,反应方程式为:NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl,
故答案为:NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl;
(3)由溶解曲线图可知KHCO3和NH4Cl的溶解度相差不大,当温度高于40℃时,由图象可知,降温结晶时会析出较多的KCl,无法大量析出碳酸氢钾,所以该方法不可行,
故答案为:不可行,因为KHCO3的溶解度较大,且在常温下与KCl溶解度相差小,在铵盐水碳酸化时无法大量析出;
(4)设制备出的NH4NO3的物质的量为xmol,
根据反应NH3+HNO3=NH4NO3可知:NH3~NH4NO3,由于NH3被HNO3的吸收率为98%,故在此反应中所需的NH3的物质的量为:$\frac{x}{98%}$=1.02xmol;
同时据反应可知:NH3~HNO3~NH4NO3,而由NH3制HNO3时产率为88%,故生成xmolNH4NO3,需要的制备硝酸的NH3的物质的量为:$\frac{x}{88%}$=1.136xmol,
即制得xmolNH4NO3所需的氨气的物质的量为:(1.02x+1.136x)mol,
根据氨气的质量为100t即108g可得:(1.02x+1.136x)mol×17g/mol=108g,
解得:x=2728364.07mol,
NH4NO3的质量为:m=nM=2728364.07mol×80g/mol≈218t,
故答案为:218.
点评 本题考查制碱法的工艺的流程,题目难度中等,明确制备流程及反应原理为解答关键,注意根据物质的主要性质分析工艺装置、反应原理,试题充分考查了学生的分析、理解能力及化学实验能力.

| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 碱性:KOH>Ca(OH)2>Mg(OH)2 | ||
| C. | 稳定性:HCl<H2S<PH3 | D. | 原子半径:Na<Mg<Al |
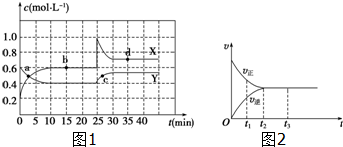
①该反应的化学方程式为(反应物或生成物用符号X、Y表示):Y?2X.
②a、b、c、d四个点中,表示化学反应处于平衡状态的点是bd.
(2)图2是可逆反应X2+3Y2?2Z在反应过程中的反应速率(v)与时间(t)的关系曲线.下列叙述正确的是bd.
a.t1时,只有正方向反应
b.t2时,反应达到限度
c.t2~t3,反应不再发生
d.t2~t3,各物质的浓度不再发生变化
(3)表中列出的是某温度和压强下,2L容器中,化学反应2SO2+O2?2SO3在不同时间点测得密闭体系中三种物质的物质的量
| 时间(s) 物质的量(mol) 物质 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.01 | 0.1 | 0.1 |
| O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
| SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
①计算20~30s期间,用二氧化硫表示的化学反应平均速率为0.0075 mol•L-1•s-1 mol/(L•min)-1.
②反应70s后,其他条件不变,只改变一个条件,使反应速率增大.则该条件可能是(要求:写出3点即可)a.加入催化剂,b.升高温度,c.增大浓度.
| A. | 玻璃钢的基体是玻璃纤维,增强体是合成树脂 | |
| B. | 玻璃钢的基体是合成树脂,增强体是玻璃纤维 | |
| C. | 玻璃钢的质地异常柔软,有强的韧性 | |
| D. | 玻璃钢有一定的导电、导热和机械加工性能 |
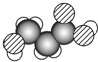 有关该物质的推断正确的是( )
有关该物质的推断正确的是( )| A. | 分子中可能含有羟基 | B. | 分子中可能含有酯基 | ||
| C. | 分子中可能含有醛基 | D. | 该物质的分子式可能为C3H4O3 |
| A. | 由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去 | |
| B. | 由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分 | |
| C. | 乙醇能与乙酸在一定条件下反应生成乙酸乙酯和水,说明乙醇具有碱性 | |
| D. | 由于乙醇容易挥发,所以才有熟语“酒香不怕巷子深”的说法 |
| A. | Al3+ | B. | S2- | C. | SO${\;}_{4}^{2-}$ | D. | HCO3- |