题目内容
(1)FeCl3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制FeCl3的溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解.
(2)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 .
(2)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的
考点:盐类水解的应用,影响盐类水解程度的主要因素
专题:盐类的水解专题
分析:(1)FeCl3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性;为防止氯化铁水解,在配制氯化铁溶液时,常将FeCl3固体先溶于较浓的盐酸中;
(2)硫化钠为强碱弱酸盐,其溶液呈碱性,在配制硫化钠溶液时,为防止其水解,可以加入少量碱.
(2)硫化钠为强碱弱酸盐,其溶液呈碱性,在配制硫化钠溶液时,为防止其水解,可以加入少量碱.
解答:
解:(1)FeCl3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性,水解离子方程式为Fe3++3H2O?Fe(OH)3+2H+,所以其溶液pH<7;在配制氯化铁溶液时,常将FeCl3固体先溶于较浓的盐酸中,从而抑制氯化铁水解,故答案为:酸;<;Fe3++3H2O?Fe(OH)3+2H+;抑制;
(2)硫化钠为强碱弱酸盐,硫离子水解而使其溶液呈碱性,水解离子方程式为S2-+H2O?HS-+OH-,在配制硫化钠溶液时,为防止其水解,可以加入少量NaOH,
故答案为:NaOH.
(2)硫化钠为强碱弱酸盐,硫离子水解而使其溶液呈碱性,水解离子方程式为S2-+H2O?HS-+OH-,在配制硫化钠溶液时,为防止其水解,可以加入少量NaOH,
故答案为:NaOH.
点评:本题考查了盐类水解,根据“谁强谁显性、谁弱谁水解”来确定溶液酸碱性,根据溶液酸碱性加入相应的酸或碱防止其水解,题目难度不大.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
下列离子方程式书写正确的是( )
| A、CuSO4溶液与Ba(OH)2溶液反应:Ba2++SO42-=BaSO4↓ |
| B、NaHSO4溶液和NaHCO3溶液反应:H++HCO3-=H2O+CO2↑ |
| C、氯化铝溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| D、澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O |
当光束通过下列物质时:①豆浆②稀硫酸③蒸馏水④淀粉溶液,没有丁达尔现象的分散系是( )
| A、②③④ | B、②④ | C、②③ | D、② |
下列叙述是某同学做完铜一锌一硫酸原电池的实验后得出的结论和认识,你认为正确的是( )
| A、构成原电池正极和负极的材料必须是两种金属 |
| B、在该原电池中,铜作负极 |
| C、铜锌原电池工作时,若有13g锌溶解,则电路中就有0.4mol电子通过 |
| D、电子通过硫酸溶液由锌流向铜,在铜电极上被氢离子得到而放出氢气 |
下列表示物质结构的化学用语或模型图正确的是( )
| A、HClO的结构式:H-O-Cl |
B、H2O2的电子式: |
C、CH4 分子的比例模型: |
D、14C的原子结构示意图: |
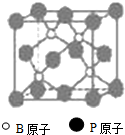 (物质结构与性质)磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元.磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr.
(物质结构与性质)磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元.磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr.