题目内容
将一定量CuO,Fe2O3的混合物全部溶在100mL 1.0mol×L-1 H2SO4中,然后通入足量H2S气体,产生沉淀1.6g。过滤后向滤液中逐滴加入2.4mol×L-1NaOH溶液,加至50mL时溶液刚好出现沉淀。求原混合物中含CuO,Fe2O3各是多少克?
解析:
设原混合物中含CuOxmol,Fe2O3为ymol CuO+H2SO4══CuSO4+H2O xmol xmol xmol Fe2O3+3H2SO4══Fe2(SO4)3+3H2O ymol 3ymol ymol CuSO4+H2S══CuS↓+H2SO4 xmol xmol xmol Fe2(SO4)3+H2S══2FeSO4+S↓+H2SO4 ymol ymol ymol 2NaOH+H2SO4══Na2SO4+2H2O 2 1
|

Ⅰ.实验表明,CuO被H2还原时也有Cu2O生成。将一定量的H2缓慢通过灼热的CuO粉末,得到固体混合物且混合物中m(Cu)∶m(O)=8∶a。当a有不同的取值时,固体混合物成分不同。请分析a的取值范围和固体混合物成分的关系并填入下表(不一定填满,表格不够也可自行增加)。
a的取值范围 | 反应后固体的成分(用化学式表示) |
|
|
|
|
|
|
Ⅱ.黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8∶7;将m g X粉末全部溶于200 mL的浓HNO3,反应后的溶液加水稀释至2.12 L时测得其pH为0;将稀释后的溶液分为两等份,向其中一份溶液中滴加6.05 mol·L-1的NaOH溶液,向另一份溶液中滴加0.600 mol·L-1 Ba(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶液的体积变化如下图所示:
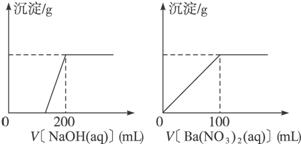
(1)请通过计算确定m的值;
(2)X的摩尔质量为368 g·mol-1,请确定X的化学式_______________
 丙+丁
丙+丁