题目内容
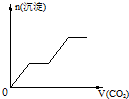
 已知Ba(AlO2)2可溶于水.如图表示的是向含A12(SO4)30.01mol的溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系(其中a、c分别是0b段和bd段的中点).下列有关叙述正确的是
已知Ba(AlO2)2可溶于水.如图表示的是向含A12(SO4)30.01mol的溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系(其中a、c分别是0b段和bd段的中点).下列有关叙述正确的是
- A.a时沉淀的质量为3.495 g
- B.b时沉淀的物质的量为0.05 mol
- C.c时溶液中Ba2+离子的物质的量为0.005 mol
- D.e时溶液中AlO2-的物质的量为0.01 mol
BC
分析:采用定量法分析,假设有1molA12(SO4)3则溶液中含有2molA13+、3molSO42-,向溶液中逐滴加入Ba(OH)2溶液时发生的反应为:Al3++3OH-=Al(OH)3↓、SO42-+Ba2+=BaSO4↓.则当2molA13+完全沉淀时,消耗Ba(OH)23mol,此时3molSO42-全部沉淀;生成沉淀为2molAl(OH)3和3molBaSO4共5mol,因此,在整个反应过程中BaSO4的物质的量始终大于Al(OH)3的物质的量;再加入Ba(OH)2溶液时发生Al(OH)3+OH-=[Al(OH)4]-,沉淀的量将逐渐减少,因此b点是沉淀的最大值,b~d中Al(OH)3沉淀逐渐溶解转化为Ba(AlO2)2,由于AlO2-微弱水解,因此再b~d中AlO2-的物质的量大于Ba2+;d点时Al(OH)3沉淀恰好完全溶解,此时溶液中只存在Ba(AlO2)2,因此随Ba(OH)2的加入在某一点,当d~e中加入的Ba(OH)2的物质的量等于Ba(AlO2)2的物质的量时,溶液中Ba2+与OH-的量相等.
解答:A、有1molA12(SO4)3则溶液中含有2molA13+、3molSO42-,向溶液中逐滴加入Ba(OH)2溶液在a点时,生成的氢氧化铝和硫酸钡的物质的量不是最大沉淀的一半,故A错误;
B、在b点时发生反应A12(SO4)3+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓,沉淀Al(OH)3和BaSO4的物质的量为0.05mol,故B正确;
C、有0.01molA12(SO4)3则溶液中含有0.02molA13+、0.03molSO42-,向溶液中逐滴加入Ba(OH)2溶液时,达到b点时,A12(SO4)3+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓,c点时,此时0.01mol的氢氧化铝会溶解,加入了0.005mol的氢氧化钡,溶液中Ba2+离子的物质的量为0.005 mol,故C正确;D、根据铝元素守恒,e时溶液中铝元素全部转化为AlO2-,它的物质的量为0.02mol,故D错误.故选BC.
点评:本题考查学生离子之间的反应知识,结合图象知识来考查,增加了难度,熟悉每一段图中对应的化学反应是解答本题的关键,题目难度中等.
分析:采用定量法分析,假设有1molA12(SO4)3则溶液中含有2molA13+、3molSO42-,向溶液中逐滴加入Ba(OH)2溶液时发生的反应为:Al3++3OH-=Al(OH)3↓、SO42-+Ba2+=BaSO4↓.则当2molA13+完全沉淀时,消耗Ba(OH)23mol,此时3molSO42-全部沉淀;生成沉淀为2molAl(OH)3和3molBaSO4共5mol,因此,在整个反应过程中BaSO4的物质的量始终大于Al(OH)3的物质的量;再加入Ba(OH)2溶液时发生Al(OH)3+OH-=[Al(OH)4]-,沉淀的量将逐渐减少,因此b点是沉淀的最大值,b~d中Al(OH)3沉淀逐渐溶解转化为Ba(AlO2)2,由于AlO2-微弱水解,因此再b~d中AlO2-的物质的量大于Ba2+;d点时Al(OH)3沉淀恰好完全溶解,此时溶液中只存在Ba(AlO2)2,因此随Ba(OH)2的加入在某一点,当d~e中加入的Ba(OH)2的物质的量等于Ba(AlO2)2的物质的量时,溶液中Ba2+与OH-的量相等.
解答:A、有1molA12(SO4)3则溶液中含有2molA13+、3molSO42-,向溶液中逐滴加入Ba(OH)2溶液在a点时,生成的氢氧化铝和硫酸钡的物质的量不是最大沉淀的一半,故A错误;
B、在b点时发生反应A12(SO4)3+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓,沉淀Al(OH)3和BaSO4的物质的量为0.05mol,故B正确;
C、有0.01molA12(SO4)3则溶液中含有0.02molA13+、0.03molSO42-,向溶液中逐滴加入Ba(OH)2溶液时,达到b点时,A12(SO4)3+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓,c点时,此时0.01mol的氢氧化铝会溶解,加入了0.005mol的氢氧化钡,溶液中Ba2+离子的物质的量为0.005 mol,故C正确;D、根据铝元素守恒,e时溶液中铝元素全部转化为AlO2-,它的物质的量为0.02mol,故D错误.故选BC.
点评:本题考查学生离子之间的反应知识,结合图象知识来考查,增加了难度,熟悉每一段图中对应的化学反应是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
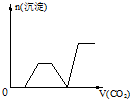
 已知Ba(AlO2)2可溶于水,图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )
已知Ba(AlO2)2可溶于水,图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )| A、b点时沉淀的物质的量:Al(OH)3>BaSO4 | B、c点时溶液中离子的物质的量:AlO2->Ba2+ | C、a-b时沉淀的物质的量:BaSO4可能小于Al(OH)3 | D、d-e时溶液中离子的物质的量:Ba2+等于OH- |
 已知Ba(AlO2)2可溶于水.如图表示的是向含A12(SO4)30.01mol的溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系(其中a、c分别是0b段和bd段的中点).下列有关叙述正确的是( )
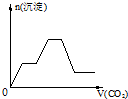
已知Ba(AlO2)2可溶于水.如图表示的是向含A12(SO4)30.01mol的溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系(其中a、c分别是0b段和bd段的中点).下列有关叙述正确的是( ) (2010?金华模拟)已知Ba(AlO2)2可溶于水.如右下图是向100mL 0.02mol?L-1KAl(SO4)2溶液中逐滴加入0.05mol?L-1Ba(OH)2溶液时(25℃),生成沉淀的物质的量与加入Ba(OH)2溶液的体积的关系.下列说法不正确的是( )
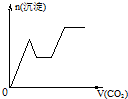
(2010?金华模拟)已知Ba(AlO2)2可溶于水.如右下图是向100mL 0.02mol?L-1KAl(SO4)2溶液中逐滴加入0.05mol?L-1Ba(OH)2溶液时(25℃),生成沉淀的物质的量与加入Ba(OH)2溶液的体积的关系.下列说法不正确的是( ) 已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述错误的是( )
已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述错误的是( )