题目内容
 如图所示,在装有活塞的密闭容器内盛22.4mL NO,若通入11.2mL O2(气体体积均在标准状况下测定),保持温度、压强不变,则容器内混合气体的密度( )
如图所示,在装有活塞的密闭容器内盛22.4mL NO,若通入11.2mL O2(气体体积均在标准状况下测定),保持温度、压强不变,则容器内混合气体的密度( )分析:根据密闭容器存在反应:2NO+O2=2NO2,2NO2?N2O4,V(NO):V(O2)=2:1,第一个反应刚好反应,产生22.4ml的NO2,容器内气体总质量=原混合物=
×30g/mol+
×32g/mol=0.046g,然后根据极限法求出气体的密度.
| 0.0224L |
| 22.4L/mol |
| 0.0112L |
| 22.4L/mol |
解答:解:密闭容器存在反应:2NO+O2=2NO2,2NO2?N2O4,V(NO):V(O2)=2:1,第一个反应刚好反应,产生22.4ml的NO2,容器内气体总质量=原混合物=
×30g/mol+
×32g/mol=0.046g,
假设不存在第二个平衡,则反应后容器的体积为:22.4ml,气体密度为
=2.05g/L;
假设第二个反应完全反应,转化为N2O4,则容器内气体为11.2ml,则密度为
=4.11g/L;
因为不能反应完全,所以密度应该在那两个值之间,即在2.05~4.11g?L-1之间,
故选D.
| 0.0224L |
| 22.4L/mol |
| 0.0112L |
| 22.4L/mol |
假设不存在第二个平衡,则反应后容器的体积为:22.4ml,气体密度为
| 0.046g |
| 0.0224L |
假设第二个反应完全反应,转化为N2O4,则容器内气体为11.2ml,则密度为
| 0.046g |
| 0.0112L |
因为不能反应完全,所以密度应该在那两个值之间,即在2.05~4.11g?L-1之间,
故选D.
点评:本题主要考查了气体密度的计算,注意极限法的使用,难度中等.

练习册系列答案
相关题目
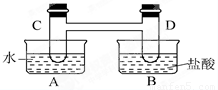
 I、如图所示,在容器A中装有20℃的水50mL,容器B中装有1mol/L的盐酸50mL,试管C、D相连通,且其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平衡:2NO2?N2O4△H=-57kJ/mol,当向A中加入50gNH4NO3晶体使之溶解;向B中加入2g苛性钠时:
I、如图所示,在容器A中装有20℃的水50mL,容器B中装有1mol/L的盐酸50mL,试管C、D相连通,且其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平衡:2NO2?N2O4△H=-57kJ/mol,当向A中加入50gNH4NO3晶体使之溶解;向B中加入2g苛性钠时:
 B.等于
B.等于
 和
和 之间
D.大于
之间
D.大于

 B.等于
B.等于
 和
和 之间
D.大于
之间
D.大于