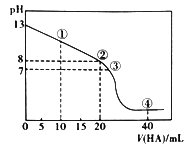
题目内容
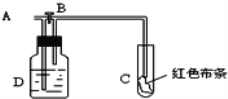
【题目】如图所示,A处通入氯气,打开B阀时,C处红色布条不褪色;关闭B阀时,C处红色布条褪色;由此作出的判断正确的是( )
A. D中可能是浓硫酸
B. 通入的氯气含有水蒸气
C. D中可能是水
D. D中可能是NaOH溶液
【答案】C
【解析】从A处通入氯气,若打开活塞B,C处的有色布条不褪色,因为干燥的氯气不具备漂白性,若关闭活塞B,C处的有色布条褪色,这说明氯气经过溶液D后带出了水,潮湿的氯气具有漂白性;发生反应为Cl2+H2O=HCl+HClO;生成的次氯酸具有漂白作用。A、D中盛放浓硫酸时,具有吸水作用,关闭活塞B,C处的有色布条不会褪色,故A错误;B、A处通入的是潮湿的氯气时,具有漂白性,若打开活塞B,C处的有色布条会褪色,故B错误;C、D中盛放水时,氯气通过会带出水,潮湿的氯气具有漂白性,关闭活塞B,C处的有色布条褪色,故C正确;D、D盛放的是氢氧化钠溶液时,会和氯气发生反应,生成氯化钠、次氯酸钠和水,这样再关闭活塞B,C处的有色布条不会褪色,故D错误;故选C。

 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
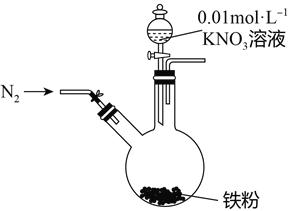
课课优能力培优100分系列答案【题目】某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应。实验步骤及现象如下:
实验步骤 | 实验现象 |
1、打开弹簧夹,缓慢通入N2 | |
2、加入pH为2.5的0.01mol/L酸性KNO3溶液100mL | 铁粉部分溶解,溶液呈浅绿色; 铁粉不再溶解后,剩余铁粉表面出现少量白色物质附着。 |
3、反应停止后,拔掉橡胶塞,将圆底烧瓶取下 | 烧瓶内气体的颜色没有发生变化。 |
4、将剩余固体过滤 | 表面的白色物质变为红褐色。 |
(1)通入N2并保持后续反应均在N2氛围中进行的实验目的是______________________________。
(2)白色物质是__________,用化学方程式解释其变为红褐色的原因:____________________。
(3)为了探宄滤液的成分,该同学进一步设计了下述实验:
实验步骤 | 实验现象 |
1、取部分滤液于试管中,向其中加入KSCN溶液 | 溶液液无变化 |
2、将上述溶液分为两份,一份中滴入氯气;另一份中滴加稀硫酸 | 两份溶液均变为红色 |
3、另取部分滤液于试管中,向其中加入浓NaOH溶液并加热,在试管口放置湿润的红色石蕊试纸。 | 有气体生成,该气体使红色石蕊试纸变蓝。 |
(i)根据以上实验现象,可以判断滤液中存在____________________离子。
(ii)步骤2中滴加稀硫酸后溶液会由浅绿色变成红色,请用离子方程式解释其原因____________________。