题目内容
【题目】下列指定反应的离子方程式正确的是
A.HCO3-水解:HCO3-+H2OCO32-+H3O+
B.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe2+
C.用惰性电极电解MgCl2溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D.NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性:Ba2++2OH-+2H++SO![]() =BaSO4↓+2H2O
=BaSO4↓+2H2O
【答案】D
【解析】
A.HCO3-水解的离子反应方程式为HCO3-+H2OH2CO3+OH-,故A错误;
B.向Fe2(SO4)3溶液中加入过量铁粉时发生的离子反应方程式为2Fe3++Fe=3Fe2+,故B错误;
C.用惰性电极电解MgCl2溶液时发生的离子反应方程式为Mg2++2Cl-+2H2O![]() Mg(OH)2↓+H2↑+Cl2↑,故C错误;
Mg(OH)2↓+H2↑+Cl2↑,故C错误;
D.NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性,此时发生的离子反应方程式为Ba2++2OH-+2H++SO![]() =BaSO4↓+2H2O,故D正确;
=BaSO4↓+2H2O,故D正确;
故答案为D。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
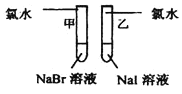
暑假作业北京艺术与科学电子出版社系列答案【题目】甲同学拟通过实验探究同主族元素性质的递变规律,以及影响化学反应速率的因素。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/盐酸、3mol/L的盐酸
(1)探究同主族元素性质的递变规律
实验步骤 | 实验现象 | 实验结论及离子反应方程式 |
| 甲:___ 乙:___ | 离子反应方程式 甲:___ 乙:___ 结论:卤素单质的氧化性由强到弱的顺序为Cl2>Br2>I2 |
评价:甲同学设计的实验方案的合理性是___(填序号)
A.非常合理 B.完全不合理 C.部分合理
补充和完善:上一项若填A,则此项不用再作答,若填B或C,则完成实验还需要的试剂后,有关反应的离子反应方程式为:___。
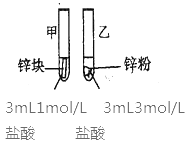
(2)探究影响化学反应速率的因素
实验步骤 | 实验现象 | 实验依据和结论 |
(金属质量相同,盐酸均过量) | 均有气体生成,锌粉先消失,锌块后消失 | 因为乙试管中的反应更快,所以反应物浓度越大,反应速率越快。 |
甲同学所得实验依据和结论有明显问题,问题是___。
(3)请你利用原电池原理,设计实验,比较铜和铁的金属活动性。画出实验装置图,标出正负极、电子流动方向___,写出电极反应式。电极反应式:____、____。
装置图